题目内容
【题目】已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,pH变化曲线如图所示(忽略温度),以下叙述正确的是
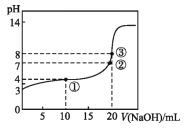
A.根据图中数据可计算出K值约为1×10-5
B.①②③点水的电离程度由大到小的顺序为:②>③>①
C.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.点③时c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
【答案】A
【解析】
试题分析:A.起点pH=3,由CH3COOHCH3COO-+H+可知,c(H+)=c(CH3COO-)=10-3mol/L,该温度下醋酸的电离平衡常数K=(103×103)/0.1=1×10-5,故A正确;B.酸或碱抑制水电离,①点溶液中含有酸,所以抑制水电离,②点呈中性,但溶质为醋酸钠和醋酸,醋酸电离程度等于醋酸根离子水解程度,水自然电离,③点溶质为醋酸钠,醋酸根离子水解促进水电离,所以①②③点水的电离程度由大到小的顺序为:③>②>①,故B错误;C.点①是加入10ml氢氧化钠溶液和醋酸反应,得到溶液中是等浓度的醋酸和醋酸钠溶液,溶液呈酸性,则c(H+)>c(OH-),醋酸的电离大于醋酸钠的水解,则c(CH3COO-)>(CH3COOH),结合溶液中电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)①,溶液中存在物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH)②,①×2+②得到:c(CH3COO-)+2c(OH-)=(CH3COOH)+2c(H+),则溶液中c(CH3COO-)+c(OH-)>(CH3COOH)+c(H+),故C错误;D.点③是加入20ml氢氧化钠溶液和醋酸反应,得到溶液中是醋酸钠溶液,结合溶液中存在物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.05mol/L,故D错误。故选A。

【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是
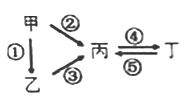
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | S | H2S | SO3 | H2SO4 |
C | N2 | NH3 | NO | NO2 |
D | Si | SiO2 | Na2SiO3 | Na2CO3 |
A. A B. B C. C D. D
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | C2H5OH | CH3COOH | 生石灰 | 蒸馏 |
B | Cl2 | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
C | NH4Cl溶液 | FeCl3 | NaOH溶液 | 过滤 |
D | 溴苯 | Br2 | NaOH溶液 | 振荡后分液 |
A. A B. B C. C D. D