题目内容
NA为阿伏加德罗常数,下列叙述正确的是
| A.14 gC2H4和C3H6的混合气体中含有的原子数为3NA |
| B.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.2NA个氢氧根离子 |
| C.5.6克铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA |
| D.1.0L1mol/L的NaOH水溶液中含有的氧原子数目为2 NA |
A
解析试题分析:B.25 ℃时, pH=13的氢氧化钡溶液中c(OH-)="0.1mol/L,1" L含有0.1NA个氢氧根离子;C.铁与稀硝酸完全反应时,硝酸过量,生成硝酸铁;铁粉过量,生成硝酸亚铁。故5.6克铁与一定量稀硝酸完全反应,电子转移数目为0.2NA~0.3NA;D.1.0L1mol/L的NaOH水溶液中含有的氧原子数目应该包括水中的氧原子,一定大于2 NA。
考点:用NA为阿伏加德罗常数计量微粒个数。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关化学用语表示正确的是
| A.含18个中子的氯原子的核素符号:17 35Cl |
B.14C的原子结构示意图: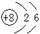 |
C.次氯酸的电子式: 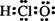 |
D.间羟基苯甲酸的结构简式: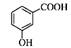 |
设nA为阿伏加德罗常数的值,下列说法正确的是
| A.1 mol·L-1的K2SO4溶液中有2nA个K+ |
| B.1 mol Cl2与足量铁反应,转移2nA个电子 |
| C.标准状况下,22.4L氨气溶于水,此溶液中含有nA个NH3分子 |
| D.所含溶质为63g的浓硝酸与足量的铜反应,生成的气体分子数为0.5nA |
设NA为阿伏加德罗常数,下列说法中正确的是
| A.O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
| B.将标准状况下22.4LNO与11.2LO2混合后的体积约为22.4L |
| C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA |
| D.标准状况下11.2LCl2溶于1L水中,转移电子的数目为0.5NA |
NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为 |
B.42 g乙烯中含碳原子数为3 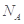 |
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22. 4)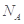 |
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3 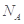 |
在25℃、1×105Pa时,等质量的H2、Cl2、CO2、C2H2四种气体中( )
| A.H2分子数最大 | B.C2H2原子数最大 |
| C.CO2密度最大 | D.Cl2分子间平均距离最大 |
下列解释事实的化学用语正确的是
A.CO2的水溶液显酸性: H2CO3  2H++CO32- 2H++CO32- |
B.电子式表示氯化氢气的形成过程: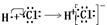 |
| C.AlCl3溶液中加入过量氨水:Al3++4NH3?H2O =AlO2-+ 4NH4++2H2O |
| D.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深: |
 2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+ 设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.在标况下, 11.2 L NO与11.2 L O2混合后所含分子数为0.75NA |
| B.常温常压下,16 g O3所含的电子数为8NA |
| C.0.1 mol Na2O2晶体中含有0.4NA个离子 |
| D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
| A.步骤Ⅰ中减少的3 g固体一定是混合物 |
| B.步骤Ⅱ中质量减少的物质一定是Cu |
| C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
| D.根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1 |