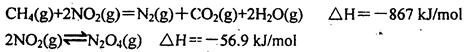题目内容
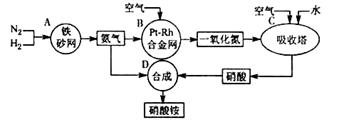
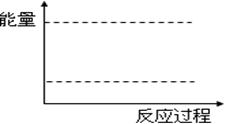
合成氨反应N2(g)+3H2(g) 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。

请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?_ _。理由是_________ ;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________ 。
 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?_ _。理由是_________ ;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________ 。
(1)小,无。△H取决于反应物的总能量和生成物的总能量差;(2)-92.2 (3)0.01 4
(4)N2(g) + 3H2(g) ? 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1
(4)N2(g) + 3H2(g) ? 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1
试题分析:(1)用铁作催化剂可以降低反应活化能E,所以加催化剂会使图中E变变小;△H取决于反应物的总能量和生成物的总能量差,所以E的大小对该反应的反应热没有影响。
(2)NH3的物质的量为17g/17g·mol-1="1mol" △H="2×-46.1" kJ="-92.2" kJ(该反应为放热反应,符号为负)
(3)NH3的变化浓度为1mol·L-1时,根据反应比,N2的浓度变化了0.5mol·L-1,v(N2)=0.5mol·L-1/50 min="0.01" mol·L-1;NH3的变化浓度为1mol·L-1时,根据反应比,H2的浓度变化了1.5 mol·L-1,C(H2)=5.5 mol·L-1-1.5 mol·L-1="4" mol·L-1
(4)N2(g) + 3H2(g) ? 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1

练习册系列答案
相关题目
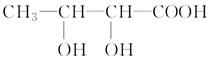
 三者关系正确的是
三者关系正确的是
 W (s) + 3H2O (g)
W (s) + 3H2O (g)  W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1  WI4 (g)。下列说法正确的有____________。
WI4 (g)。下列说法正确的有____________。 N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。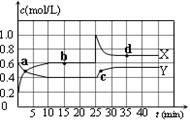
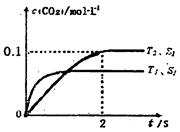
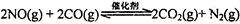 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断: