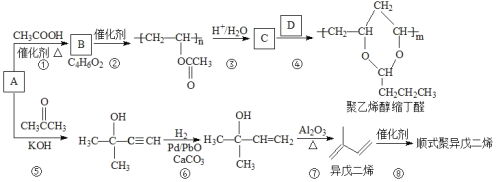
题目内容
【题目】在氯化铁溶液中存在下列平衡:FeCl3+3H2O![]() Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
【答案】(1)生成红褐色沉淀 (2)Fe2O3 (3)浓盐酸
(4)MgCO3与Fe3+水解产生的H+反应,促进了Fe3+水解,使Fe3+转化为Fe(OH)3沉淀而除去。
【解析】
试题(1)MgCl2是电解质,可使胶体聚沉,所以会产生红褐色沉淀。
(2)Fe(OH)3失水得到Fe2O3。
(3)在FeCl3溶液中加入浓盐酸使Fe3+水解平衡左移,防止反应FeCl3+3H2O![]() Fe(OH)3+3HC1发生,产生Fe(OH)3。
Fe(OH)3+3HC1发生,产生Fe(OH)3。
(4)氯化铁和碳酸镁的水解互相促进。即MgCO3与Fe3+水解产生的H+反应,促进了Fe3+水解,使Fe3+转化为Fe(OH)3沉淀而除去。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目