题目内容
下列说法正确的是( )
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(I)═N2(g)+2H2(g)是一个△S>0的反应 |
| C、40g金刚砂(SiC)中含有C-Si键的个数为2NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
考点:化学键,不同晶体的结构微粒及微粒间作用力的区别,反应热和焓变,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:A、碘化氢要发生分解,氯化氢不发生分解;
B、气体系数之和增大,则△S>0;
C、1个金刚砂(SiC)中含有C-Si键的个数为4;
D、NaClO属于盐,为强电解质.
B、气体系数之和增大,则△S>0;
C、1个金刚砂(SiC)中含有C-Si键的个数为4;
D、NaClO属于盐,为强电解质.
解答:
解:A、碘化铵和氯化铵受热分解过程中离子键发生断裂,碘化铵分解产生的碘化氢还要发生分解,共价键断裂,但氯化铵产生的氯化氢不发生分解,所以分解过程中破坏和形成的化学键类型不完全相同,故A错误;
B、气体系数之和增大,则△S>0,则反应N2H4(I)═N2(g)+2H2(g)是一个△S>0的反应,故B正确;
C、1个金刚砂(SiC)中含有C-Si键的个数为4,则40g即1mol金刚砂(SiC)中含有C-Si键的个数为4NA(NA为阿伏加德罗常数),故C错误;
D、HClO属于弱酸,但NaClO属于盐,为强电解质,故D错误;
故选B.
B、气体系数之和增大,则△S>0,则反应N2H4(I)═N2(g)+2H2(g)是一个△S>0的反应,故B正确;
C、1个金刚砂(SiC)中含有C-Si键的个数为4,则40g即1mol金刚砂(SiC)中含有C-Si键的个数为4NA(NA为阿伏加德罗常数),故C错误;
D、HClO属于弱酸,但NaClO属于盐,为强电解质,故D错误;
故选B.
点评:本题主要考查了化学键的断裂与形成、△S的判断,化学键的计算等,难度不大,注意知识的积累.

练习册系列答案
相关题目
室温下,下列溶液中c(H+)最小的是( )
| A、c(OH-)=1×10-11mol?L-1 |
| B、pH=3的CH3COOH溶液 |
| C、pH=4的H2SO4溶液 |
| D、c(H+)=1×10-3mol?L-1 |
电泳实验发现,硫化砷胶粒向阳极移动,下列措施不能使硫化砷胶体凝聚的是( )
| A、加入Al2(SO4)3溶液 |
| B、加入硅酸胶体 |
| C、加热 |
| D、加入Fe(OH)3胶体 |
下列实验无法达到下列目的是( )
| A、用升华法分离碘和NaCl的混合物 |
| B、用结晶法分离KNO3和NaCl的混合物 |
| C、用分液法分离水和汽油的混合物 |
| D、用蒸馏法分离乙醇(沸点为78℃)和乙酸乙酯(沸点为77.5℃)的混合物 |
下列有机物的命名中,不正确的是( )
| A、3,3-二甲基丁烷 |
| B、3-甲基-3-乙基戊烷 |
| C、4-甲基-3-乙基-2-己烯 |
| D、1-甲基-2-乙基-3-丙基苯 |
用2mol/L的NaOH溶液滴定pH=2的HCN溶液100mL至中性,此时溶液中各离子浓度关系正确的是( )
| A、c(Na+)>c(CN-)>c( OH-)>c(H+) |
| B、c(CN-)>c(Na+)>c(H+)>c( OH-) |
| C、c(Na+)+c(CN-)=2mol/L |
| D、c(Na+)+c( OH-)=c(CN-)+c(H+) |
活性炭可除水中氯气,反应为2Cl2+2H2O+C═4HCl+CO2,若水中Cl2浓度为4.0×10-6 mol/L,则每消耗96g活性炭,可处理上述水的体积是( )
| A、188.3 L |
| B、4.0×1010L |
| C、4.0×106L |
| D、8.0×106 L |
关于下列各装置图的叙述不正确的是( )
A、 用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
B、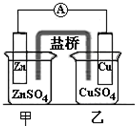 装置的盐桥中KCl的Cl-移向甲烧杯 |
C、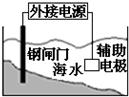 装置中钢闸门应与外接电源的正极相连获得保护 |
D、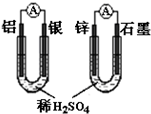 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |