题目内容
下列说法不正确的是( )
A.多孔碳可用作氢氧燃料电池的电极材料
B.pH计不能用于酸碱中和滴定终点的判断
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
C. 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物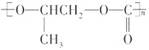 ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
B
解析

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确的是( )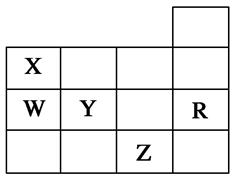
| A.常压下五种元素的单质中Z单质的沸点最低 |
| B.Y、Z阴离子电子层结构都与R原子相同 |
| C.W的原子半径比X的小 |
| D.Y元素的非金属性比W元素的非金属性强 |
下列说法正确的是( )
| A.F、Cl、Br的最外层电子数都是7,次外层电子数都是8 |
| B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律 |
| C.卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加电子层数增大起主要作用 |
| D.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,砹易溶于水,难溶于CCl4 |
X、Y、Z、W是短周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.原子半径由小到大的顺序为X<Y<Z<W |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.X、Z、W最高价氧化物对应水化物酸性的强弱顺序为Z<X<W |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是( )
| A.原子半径的大小顺序:rX>rY>rW>rQ |
| B.X、Y的最高价氧化物的水化物之间不能反应 |
| C.Z、W最外层电子数都为6,最高化合价都为+6价 |
| D.元素Q和Z能形成QZ2型的共价化合物 |
能说明元素X的原子得电子能力强于元素Y的原子的事实是( )
| A.元素周期表中元素X位于元素Y的上一个周期 |
| B.元素X的含氧酸的酸性强于元素Y的含氧酸 |
| C.分别加热H2X、HY至500 ℃,只有HY发生分解 |
| D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是( )
| J | | |
| | | R |
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
下列说法正确的是 ( )。
| A.金属元素和非金属元素间形成的化学键一定是离子键 |
| B.ⅦA族元素是同周期元素中非金属性最强的元素 |
| C.全部由非金属元素形成的化合物一定是共价化合物 |
| D.短周期中,同周期元素的离子半径从左到右逐渐减小 |