题目内容
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构.以下关于A、B元素性 质 的比较中,错误的是:
A.原子序数:A>B B.原子半径:A<B
C.离子半径:aAm+<bBn- D.元素所在的周期数:A>B
B
解析试题分析:由题意可知,A的阳离子aAm+与元素B的阴离子bBn-的核外电子数相同,所以满足阴上阳下的原则,元素A在下一周期,元素B在上一周期, A、原子序数A>B,正确;B、原子半径A>B,错误;C、离子半径主要由电子层数、核电荷数决定,前者相同时核电荷数越少半径越大,aAm+<bBn-,正确;D、A所在周期>B所在周期,正确,答案选B。
考点:考查原子结构与元素性质的关系

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
下图是元素周期表的一部分,下列说法正确的是( )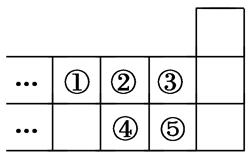
| A.元素①位于第二周期第ⅣA族 |
| B.气态氢化物的稳定性:④<② |
| C.最高价氧化物对应水化物的酸性:⑤<④ |
| D.元素③的最高价是+7 |
下列排序正确的是( )
| A.酸性:H2CO3<C6H5OH<CH3COOH | B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<BN | D.沸点:PH3<NH3<H2O |
某矿石由前20号元素中的4种组成,其化学式为WmYnZpXq。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
| A.气态氢化物的稳定性:X<Z |
| B.含有1 mol Y的氯化物的水溶液中离子总数为4 mol(不考虑水的电离) |
| C.W位于第三周期ⅠA族,其原子半径比其他元素的都大 |
| D.2 mol W单质和1 mol Y单质投入足量的水中会产生2.5 mol气体 |
下列叙述中正确的是( )
| A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构 |
| D.24Mg34S晶体中电子总数与中子总数之比为1∶1 |
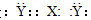
 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物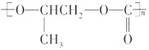 ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则