题目内容
能说明元素X的原子得电子能力强于元素Y的原子的事实是( )
| A.元素周期表中元素X位于元素Y的上一个周期 |
| B.元素X的含氧酸的酸性强于元素Y的含氧酸 |
| C.分别加热H2X、HY至500 ℃,只有HY发生分解 |
| D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY |
C
解析

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
短周期元素X、Y、Z、W的原子序数依次增大,其中Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等,Z单质可以用来冶炼其它熔点较高的金属,X和W间可形成一种能产生酸雨的化合物,则下列说法不正确的是
| A.原子半径从大到小顺序为:W>Z>Y>X |
| B.X与Y可形成既含离子键又含非极性共价键的化合物 |
| C.X、W分别形成简单的氢化物中,前者的沸点高 |
| D.X形成单核阴离子的核外电子数与Y、Z、W原子的核外内层电子数相同 |
下列叙述中,能肯定A金属比B金属活泼性强的是( )
| A.A原子的最外层电子数比B原子的最外层电子数少 |
| B.A原子的电子层数比B原子电子层数多 |
| C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多 |
| D.常温时,A能从水中置换出H2,而B不能 |
某矿石由前20号元素中的4种组成,其化学式为WmYnZpXq。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
| A.气态氢化物的稳定性:X<Z |
| B.含有1 mol Y的氯化物的水溶液中离子总数为4 mol(不考虑水的电离) |
| C.W位于第三周期ⅠA族,其原子半径比其他元素的都大 |
| D.2 mol W单质和1 mol Y单质投入足量的水中会产生2.5 mol气体 |
下列叙述中正确的是( )
| A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构 |
| D.24Mg34S晶体中电子总数与中子总数之比为1∶1 |
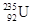 是重要的核工业原料,但在自然界的丰度很低,
是重要的核工业原料,但在自然界的丰度很低,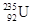 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关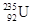 说法正确的是( )
说法正确的是( )
A.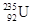 原子核中含有92个中子 原子核中含有92个中子 | B.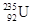 原子核外有143个电子 原子核外有143个电子 |
C.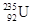 与 与 是同一种核素 是同一种核素 | D.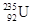 与 与 互为同位素 互为同位素 |

 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物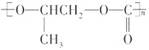 ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则