题目内容
10、能源可划分为一级能源和二级能源,自然界直接提供的能源为一级能源,需要消耗其它能源的能量间接获取的能源称为二级能源。下列关于能源的说法正确的是
C.电能是一级能源 D.煤气是一级能源
C.电能是一级能源 D.煤气是一级能源
A
水利可以发电,属于一级能源。电能是二级能源。煤气需要利用碳在高温下和水蒸气反应生成,属于二级能源,所以答案是A。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
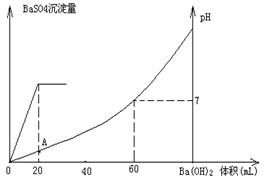
 H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。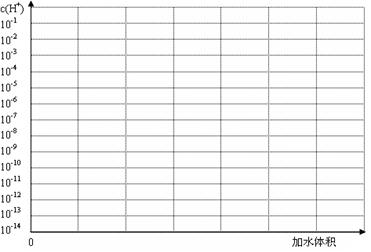
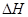 的绝对值均正确)
的绝对值均正确)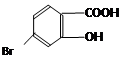 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。