题目内容
硫酸和盐酸混合溶液20mL,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生下图所示的变化。
⑴开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵在A点溶液的pH是多少?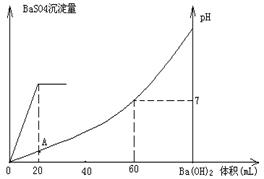
⑴开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵在A点溶液的pH是多少?

(1)关键图像可判断和硫酸反应的氢氧化钡是20ml,和盐酸反应的氢氧化钡是40ml。氢氧化钡和硫酸反应的方程式为:H2SO4+Ba(OH)2=2H2O+BaSO4↓
1mol 1mol
0.02L×c 0.02L×0.05mol/L
因此c=0.05mol/L
盐酸和氢氧化钡反应的方程式为:Ba(OH)2+2HCl=BaCl2+2H2O
_ 1mol 2mol
_ 0.04L×0.05mol/L 0.02L×c
所以c=0.20mol/L
(2)在A点硫酸恰好反应,溶液中只有盐酸,此时溶液的体积是40ml,所以溶液中氢离子
浓度为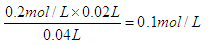 ,所以pH=1.0
,所以pH=1.0
1mol 1mol
0.02L×c 0.02L×0.05mol/L
因此c=0.05mol/L
盐酸和氢氧化钡反应的方程式为:Ba(OH)2+2HCl=BaCl2+2H2O
_ 1mol 2mol
_ 0.04L×0.05mol/L 0.02L×c
所以c=0.20mol/L
(2)在A点硫酸恰好反应,溶液中只有盐酸,此时溶液的体积是40ml,所以溶液中氢离子
浓度为
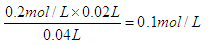 ,所以pH=1.0
,所以pH=1.0考查根据化学方程式进行的计算以及pH的计算。向混合液中滴加氢氧化钡溶液,可以可知氢氧化钡先和硫酸反应,生成硫酸钡沉淀和水,然后再和盐酸反应水氯化钡和水。根据图像可知和硫酸反应的氢氧化钡水20ml,恰好反应时,消耗氢氧化钡是60ml,所以和盐酸反应的氢氧化钡是40ml,因此根据有关的方程式可以进行计算。计算溶液的pH关键是算出溶液中氢离子的浓度,A点溶液中只有盐酸可以电离出氢离子,因此可以计算氢离子的浓度,但需要注意的是溶液的体积也发生了变化,即此时溶液的体积是40ml。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目