题目内容
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
【答案】
(1)0.2mol/L;
(2)0.12mol/(Ls);
(3)1;(4)不变;(5)减小;
【解析】
试题分析:经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1;
2L(g)+3M(g)![]() Q(g)+3R(g)
Q(g)+3R(g)
起始量(mol) 2 3 0 0
变化量(mol) 1.6 2.4 0.8 2.4
10s末(mol) 0.4 0.6 0.8 2.4
(1)10s末L的物质的量浓度=![]() =0.2mol/L;
=0.2mol/L;
(2)前10s内用M表示的化学反应速率= =0.12mol/(Ls);
=0.12mol/(Ls);
(3)经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1;
(4)在恒温恒容条件,往容器中加入1mol氦气,总压增大,分压不变平衡不动,反应速率不变;
(5)在恒温恒压条件,往容器中加入1mol氦气,为保持恒压条件增大,压强减小,反应速率减小。

 阅读快车系列答案
阅读快车系列答案【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
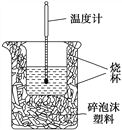
(1)该图中有两处未画出,它们是__________、__________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中所测出的“中和热”将______(填“偏大”“偏小”或“不变”);原因是_________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________。
(5)取50mL 0.5mol/LNaOH溶液和30mL 0.5mol/L硫酸进行实验,实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.1 | 26.3 | 26.2 | 30.5 | |
2 | 27.0 | 27.4 | 27.2 | 34.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.0 | |
酸碱溶液的密度均近似为1g/mL,中和后溶液的比热容c =4.18J/(g·℃)。则根据表中数据计算中和热△H 为_________________
(6)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L -130 mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度

