题目内容
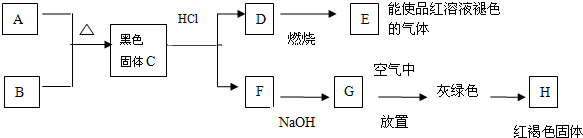
6.工业上为了处理含Cr2O72-酸性工业废水,按下面方法处理:往工业废水中加入适量的NaCl,以铁为二个电极材料进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准.(1)电极反应式:阳极Fe-2e-═Fe2+,阴极2H++2e-═H2↑.
(2)由Cr2O72- 变为Cr3+的离子方程式(酸性环境中)6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
分析 (1)Fe为电极进行电解时,阳极上铁失电子发生氧化反应,阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成;
(2)酸性条件下,Cr2O72-和亚铁离子发生氧化还原反应,生成铁离子和铬离子.
解答 解:(1)Fe为电极进行电解时,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上氢离子得电子发生还原反应,即2H++2e-═H2↑,
故答案为:Fe-2e-═Fe2+;2H++2e-═H2↑;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
点评 本题考查了电解池原理的应用,还涉及氧化还原反应等知识点,明确各个电极上发生的反应是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点,题目难度中等.

练习册系列答案
相关题目
17.某化学兴趣小组用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其设计工艺流程如下,下列说法中,错误的是( )
盐卤$→_{操作①}^{足量的石灰浆}$Mg(OH)2$\stackrel{适量盐酸}{→}$MgCl2溶液$\stackrel{操作②}{→}$MgCl2•6H2O$→_{操作③}^{HCl气流}$MgCl2$→_{操作④}^{电解}$Mg.
盐卤$→_{操作①}^{足量的石灰浆}$Mg(OH)2$\stackrel{适量盐酸}{→}$MgCl2溶液$\stackrel{操作②}{→}$MgCl2•6H2O$→_{操作③}^{HCl气流}$MgCl2$→_{操作④}^{电解}$Mg.
| A. | 操作①中发生的反应为非氧化还原反应 | |
| B. | 在整个制备过程中,未发生氧化还原反应 | |
| C. | 操作①是过滤 | |
| D. | 操作②是蒸发浓缩、冷却结晶 |
1.下列关于反应过程中能量变化的表达正确的是( )
| A. | 丁烷的燃烧热是2878 kJ/mol,则表示丁烷燃烧热的热化学方程式为:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2878 kJ/mol | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2.则△H1>△H2 | |
| C. | 已知①2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1,则a<b | |
| D. | 在一定条件下,某可逆反应的△H=+100 kJ•mol-1,则该反应正反应活化能比逆反应活化能大100 kJ•mol-1 |
11.某有机物A(C8H16O2)能发生如图所示的变化,其中C与F是同分异构体.则符合该条件的A的同分异构体有( )
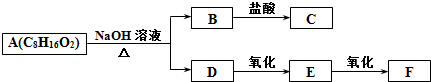

| A. | 1种 | B. | 2种 | C. | 4种 | D. | 16种 |
18.下列现象与胶体的性质无关的是( )
| A. | 江河的入海口易形成沙洲 | |
| B. | 水泥厂、冶金厂常用高压电进行除尘 | |
| C. | 医院里对肾衰患者进行血液透析 | |
| D. | 氯化钠溶液中加入硝酸银溶液产生白色沉淀 |
16.在一密闭容器中,反应2A(g)?2B(g)+C(?)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率降低了 | ||
| C. | C为气态 | D. | C为固态或液态 |