题目内容
【题目】下列对相关有机物的叙述正确的是( )

A. 甲苯分子的所有原子可能在同一平面上
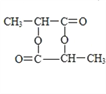
B. 上图所示的物质的名称为3甲基1丁烯
C. 分子式为C3H6O2的羧酸和分子式为C3H8O的醇反应可生成4种不同结构的酯
D. 等质量的乙烯和乙醇在氧气中完全燃烧时消耗氧气的量相同
【答案】B
【解析】
A.甲苯分子中甲基为四面体结构,不可能共面,故A错误;B.上图所示的物质为烯烃,在命名时应从离子双键较近的一端来编号,故其名称为3甲基1丁烯,故B正确;C.分子式为C3H6O2的羧酸对应的结构只有一种,为CH3CH2COOH,而分子式为C3H8O的醇的结构有2种,分别为:CH3CH2CH2OH、CH3CH(OH)CH3,相互酯化可得2种不同结构的酯,故C错误;D.由乙烯和乙醇在氧气中完全燃烧的方程式可知如下关系:C2H4~3O2、C2H6O~3O2,则有当消耗氧气均为3mol时,需要乙烯为28g,需要乙醇46g,质量不同,反过来,当两者的质量相同是,消耗的氧气也不相同,故D错误;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。

步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二:打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C试管中溶液的pH。
结合上述实验,回答以下问题:
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_______________________。
(2)甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质_____________,该物质发生电离所致。
(3)通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是_______________________。
测定结果如下:
第1次实验 | 第2次实验 | 第3次实验 | |
B瓶中pH | 2.15 | 2.10 | 2.17 |
C瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现:C瓶中溶液的酸性始终比B瓶中的酸性强。
(4)通过查阅文献,I﹣可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程分两步进行如下,将ii补充完整。
i.SO2+4I﹣+4H+=S↓+2I2+2H2O
ii.I2+2H2O+___═___+___+2I﹣
(5)最终结论:C瓶中溶液酸性强于B瓶,是由于生成了____________,该过程中体现出二氧化硫哪些化学性质________________(选填“氧化性”,“还原性”)。