题目内容
某二元酸(化学式用H2A)表示,在水中的电离方程式是:
H2A = H+ + HA-, HA- H+ + A2- 回答下列问题:
H+ + A2- 回答下列问题:
(1)Na2A溶液呈 (填”酸性,中性或碱性”),理由是,用离子方程式表示:
.
(2)若0.1 mol?L-1NaHA溶液的pH = 2,则0.1 mol?L-1H2A溶液中氢离子的物质的量浓度可能是___________0.11 mol?L-1(填>、<、=)。理由是_________________________
(3)0.1 mol?L-1NaHA溶液中各种离子浓度由大到小的顺序是______________________
(1)碱性, A2- + H2O  HA- + OH-
HA- + OH-
(2)?,第一步电离的氢离子抑制了第二步的电离。(3)c(Na+)? c(HA-)? c(H+) ?c(A2-)?c(OH-)
解析试题分析:(1)H2A的第一步电离是完全的,而第二步存在电离平衡,所以Na2A溶液呈碱性,这是由于A2水解导致的,水解方程式是A2- + H2O  HA- + OH-。
HA- + OH-。
(2)由于第一步电离的氢离子抑制了第二步的电离,所以0.1 mol?L-1H2A溶液中氢离子的物质的量浓度小于0.11mol/L。
(3)NaHA溶液中只存在电离平衡,则0.1 mol?L-1NaHA溶液中各种离子浓度由大到小的顺序是c(Na+)? c(HA-)> c(H+) >c(A2-)>c(OH-)。
考点:考查弱电解质的电离、外界条件对电离平衡的影响以及溶液中离子浓度的大小比较
点评:该题是中等难度的试题,试题基础性强,紧扣教材基础知识。注重对学生能力的培养,注重培养学生灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣,也有助于培养学生的逻辑推理能力和抽象思维能力。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
 H++A2-回答下列问题:
H++A2-回答下列问题: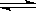 H+ +
A2- 回答下列问题:
H+ +
A2- 回答下列问题: H++A2-回答下列问题:
H++A2-回答下列问题: