题目内容
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
(1) a=7时,HA为强酸,a>7,HA为弱酸 (2) C
(3) c(Na+ ) >c(A— ) >c( OH—) >c( H+) (4) 10—4—10—6 (5) AC
解析:
考查一元强酸与弱酸的比较及溶液中离子浓度比较问题。中等难度。(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐的pH,a=7为强酸,a>7为弱酸;(2)据电荷守恒,有c(Na+ ) + c( H+)= c(A—) + c( OH—-),因c( H+)= c( OH—) ,所以c(Na+)=c (A—);(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的的电离,离子浓度大小关系为c(Na+ ) >c(A— ) >c( OH—) >c( H+);(4)据电荷守恒c(Na+ ) + c( H+)= c(A—) + c( OH—),推导c(Na+ )—c(A—)= c( OH—)—c( H+)=10—4—10—6(5)注意题干中的电离方程式,判断A项为B元素的物料守恒,C项为溶液中的质子守恒。

(2013?焦作一模)常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
|
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA的浓度/(mol/L) |
NaOH的浓度/(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s)  Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。


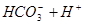









请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;