题目内容
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol?L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶的溶液从
红
红
色变为无
无
色时,停止滴定;(2)滴定时边滴边摇动锥形瓶,眼睛观察
b
b
(填序号)a.滴定管内液面的变化b.锥形瓶内溶液颜色的变化
(3)步骤①中错误的操作时
用待测溶液润洗锥形瓶
用待测溶液润洗锥形瓶
(请指出具体的错误).由此造成的测定结果是偏高
偏高
(填偏高、偏低或无影响);(4)②缺少的操作是
用标准液润洗酸式滴定管;
用标准液润洗酸式滴定管;
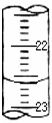
;(5)某次滴定时的滴定管中的液面如图,其读数为
22.60
22.60
ml.(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
0.1250
0.1250
mol?L-1.分析:(1)根据滴定终点,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,应停止滴定;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=
分析误差.
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)根据滴定管的精确度为0.01mL;
(6)根据c(待测)=
计算,V(标准)用两次的平均值;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗;
(5)根据滴定管的精确度为0.01mL;
(6)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:解:(1)因滴定终点时,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,停止滴定;
故答案为:红;无;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
故选:b;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据c(待测)=
,可知c(标准)偏大,故答案为:待测溶液润洗锥形瓶;偏高;
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗,
故答案为:用标准液润洗酸式滴定管;
(5)滴定管中的液面读数为22.60mL,故答案为:22.60;
(6)V(标准
═25.00mL,
c(待测)=
=
═0.0.1250mol?L-1,
故答案为:0.1250;
故答案为:红;无;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
故选:b;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(4)根据酸式滴定管用蒸馏水洗净后,应用标准液润洗,
故答案为:用标准液润洗酸式滴定管;
(5)滴定管中的液面读数为22.60mL,故答案为:22.60;
(6)V(标准
| [(25.40-0.50)+(29.10-4.00)]mL |
| 2 |
c(待测)=
| c(标准)×V(标准) |
| V(待测) |
| 0.1000mol?L×25.00mL |
| 20.00mL |
故答案为:0.1250;
点评:本题主要考查了中和滴定操作以及注意事项,难度不大,应注意相关知识的积累.

练习册系列答案
相关题目
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: