题目内容
【题目】将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)![]() xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
xC(g)+2D(g),经5min后达到平衡,测得D的浓度为0.5mol/L,c(A)︰c(B)=3︰5,C的平均反应速率是0.1mol/(L·min)
请计算:(写出计算过程,无过程不给分)
(1)平衡时A的浓度;______反应开始前容器中B的物质的量;_____
(2)前5 min内用B表示的平均反应速率;______
(3)化学反应方程式中x的值;_____
(4)5min时物质A的转化率。____
【答案】0.75 3 0.05 2 50%
【解析】
(1)先根据D的浓度求出D的物质的量,再由方程式求出A、B的物质的量;
(2)先求出反应的B的物质的量,再根据平均反应速率公式计算B的平均反应速率;
(3)根据同一反应中反应速率之比等于化学计量数之比求出x值;
(4)5min时物质A的转化率为=A的变化量/A的起始量×100%.
(1)5分钟后,n(D)=CV=0.5mol·L-1×2L=1mol,设反应开始前放入容器中A、B物质的量为mmol,
3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
n前/mol m m 0 0
n后/mol( m-1.5)( m-0.5) 1
c(A):c(B)=3:5=( m-1.5):( m-0.5)
m=3 mol
此时A的浓度c(A)=(3-1.5)mol/2L=0.75mol·L-1;
(2)设反应的B的物质的量为nmol,
3A(g)+B(g)![]() xC(g)+2D(g),
xC(g)+2D(g),
1 2
nmol 1mol
n=0.5
根据v(B)=![]() =0.05 mol/(L.min)
=0.05 mol/(L.min)
(3)根据同一反应中反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L·min):0.1mol/(L·min)=1:x,所以x=2;
(4)5min时物质A的转化率为=A的变化量/A的起始量×100%=1.5/3×100%=50%.

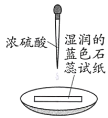
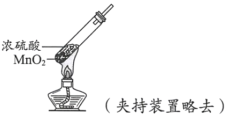
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性