题目内容
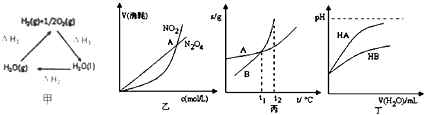
【题目】在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示. 
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是: ②; .
③; .
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为;
(3)该反应的△H0,其判断理由是
(4)该反应进行到4.0min时的平均反应速率: 实验②:vB=
实验③:vc= .
【答案】
(1)加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%;0.06mol/L
(3)>;温度升高,平衡向正反应方向移动,
(4)0.014mol(L?min)﹣1;0.009mol(L?min)﹣1
【解析】解:(1)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
所以答案是:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小;(2)由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L﹣0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为 ![]() ×100%=40%;
×100%=40%;
实验③平衡时A的浓度为0.04mol/L,故A的浓度变化量0.1mol/L﹣0.04mol/L=0.06mol/L,由方程式可知C的浓度变化量为0.06mol/L,故平衡时C的浓度为0.06mol/L,
所以答案是:40%;0.06mol/L;(3)因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
所以答案是:>;温度升高,平衡向正反应方向移动;(4)实验②中,vA= ![]() =0.007mol(Lmin)﹣1,所以vB=2vA=0.014mol(Lmin)﹣1;
=0.007mol(Lmin)﹣1,所以vB=2vA=0.014mol(Lmin)﹣1;
实验③中,vA= ![]() =0.009mol(Lmin)﹣1,所以vC=vA=0.009mol(Lmin)﹣1,
=0.009mol(Lmin)﹣1,所以vC=vA=0.009mol(Lmin)﹣1,
所以答案是:0.014mol(Lmin)﹣1;0.009mol(Lmin)﹣1.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】下列有关有机物的说法正确的是( )
A.1mol ![]() 能与4molNaOH充分反应
能与4molNaOH充分反应
B.![]() 系统命名法为3﹣丁烯
系统命名法为3﹣丁烯
C.![]() 的碳原子都在一个平面内,且它的二氯代物为3种
的碳原子都在一个平面内,且它的二氯代物为3种
D.1mol ![]() 可以与4molH2发生加成
可以与4molH2发生加成
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( ) 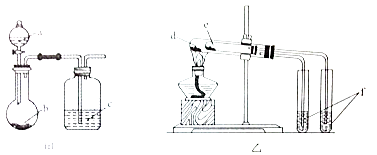
选项 | 实验试剂 | 实验结论 | ||
A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
A.A
B.B
C.C
D.D