题目内容
某单质能与足量的浓HNO3反应放出NO2气体,若参加反应的单质和硝酸的物质的量之比为1:a,则该元素在反应中所显示的化合价是( )
| A、+2a | ||
| B、+a | ||
C、+
| ||
D、+
|
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:单质X与足量的浓硝酸反应,放出NO2气体,硝酸被还原,化合价降低1价,与金属的反应中硝酸表现为酸性和氧化性,与非金属的反应中硝酸只表现为氧化性,设单质的化合价为+n,根据单质可能为金属或非金属两种情况结合电子得失守恒解答该题.
解答:
解:如为金属单质:设该金属元素的化合价是+n价,如果金属的物质的量是1mol,则没有被还原的硝酸是nmol,所以被还原的硝酸是(a-n)mol,则根据电子的得失守恒可知,n=a-n,解得n=0.5a,
如为非金属单质:没有硝酸盐生成,硝酸只表现为氧化性,若参加反应的单质X与硝酸的物质的量之比为1:a,则消耗硝酸amol,则有n=a,
故选B.
如为非金属单质:没有硝酸盐生成,硝酸只表现为氧化性,若参加反应的单质X与硝酸的物质的量之比为1:a,则消耗硝酸amol,则有n=a,
故选B.
点评:该题是高考中的常见考点,属于中等难度的试题,该题的解题思路是根据氧化还原反应中得失的得失守恒进行,本题有利于培养学生分析问题、解决问题的能力,有利于调动学生的学习积极性,注意单质可能为金属或非金属两种情况.

练习册系列答案
相关题目
标准状况下,2mol Cl2和2mol H2O相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
下列反应属于取代反应的是( )
A、2CH3CHO+O2
| ||||
B、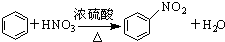 | ||||
C、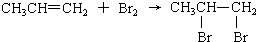 | ||||
D、nCH2=CH2
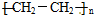 |
下列化学用语表示正确的是( )
A、CO(NH2)2的电子式: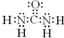 |
| B、NaHCO3的电离方程式:NaHCO3═Na++H++CO32- |
| C、1-丙醇的结构简式:C3H7OH |
| D、含18个中子的氯原子的核素符号:3517Cl |
下列离子方程式中正确的是( )
| A、Fe(OH)3滴加稀盐酸:OH-+H+=H2O |
| B、向石灰乳[Ca(OH)2]溶液通入过量的二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
| C、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
| D、NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓ |
下列各组物质充分反应后,滴入KSCN溶液一定显红色的是( )
| A、FeO放入稀HCl中 |
| B、FeCl3、CuCl2的混合溶液中加入过量的铁粉 |
| C、Fe(NO3)2固体溶于稀H2SO4中 |
| D、Fe放入HNO3溶液中 |
下列关于实验操作中先后顺序的叙述错误的是( )
| A、实验室制取气体时,先装药品,再检查装置气密性 |
| B、用托盘天平称量药品时,先调节天平平衡,再称量 |
| C、实验室用CO与Fe2O3反应制取铁时,先通CO,再点燃酒精灯 |
| D、稀释浓硫酸时,先在烧杯内倒入水,再缓慢注入浓硫酸,并不断搅拌 |
下列有关化学用语表示正确的是( )
A、N2的电子式: |
| B、质子数为53、中子数为78的碘原子:131I |
| C、HClO的结构简式:H-Cl-O |
D、S2-的结构示意图: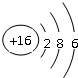 |