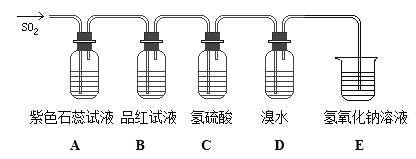
题目内容
【题目】氮的化合物在生产生活中广泛存在.
(1)处理生活污水中的NH4+ , 过程如图1: 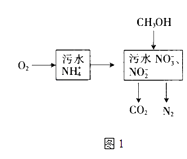
①根据较新的研究表明,将只含NO2﹣的污水与含NH4+的污水按比例混合,直接转化为无毒气体,该气体为 .
②空气将NH4+转变为NO3﹣或NO2﹣ , 溶液pH(填“增大”、“减小”或“不变”).
③完全处理含1mol NH4+污水,则n(O2)与n(CH3OH)关系式为[用n(O2)与n(CH3OH)表示].
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s )N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图2所示: 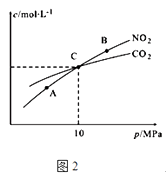
①A、B两点的浓度平衡常数关系:Kc(A)Kc(B) (填“>”、“<”或“﹦”).
②A、B、C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点.
③计算C点时该反应的压强平衡常数Kp(C)=(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
【答案】
(1)N2;减小;4n(O2)=3+6n(CH3OH)
(2)=;A;2MPa
【解析】解:(1)①NO2﹣的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气;所以答案是:N2;②空气将NH4+转变为NO3﹣或NO2﹣的反应为:NH4++2O2=NO3﹣+2H++H2O,酸性增强,PH减小;所以答案是:减小; ③全处理含1mol NH4+污水,整个过程铵根离子、甲醇是还原剂,只有氧气是氧化剂,氧气得到的电子为4n(O2)mol,1molNH4+失电子为3mol,甲醇失电子为6n(CH3OH),根据得失电子守恒则:4n(O2)=3+6n(CH3OH);
所以答案是:4 n(O2)=3+6n(CH3OH);(2)①A、B两点温度相等,所以化学平衡常数相等;所以答案是:=; ②由方程式可知反应气体体积减小,增大压强,平衡逆向移动,NO2的转化率降低,A、B、CA点压强最小,所以转化率最高;所以答案是:A; ③设生成二氧化碳2x mol,列三段式:
2NO2(g)+ | 2C(s ) | N2(g)+ | 2CO2(g) | ||
起始物质的量: | 1 | 0 | 0 | ||
转化物质的量: | 2x | x | 2x | ||
平衡物质的量: | 1-2x | x | 2x |
C点时NO2和CO2浓度相等,则1﹣2x=2x,解得:x=0.25,因,C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),Kp(C)= ![]() =Kp(N2)=10MPa×
=Kp(N2)=10MPa× ![]() =2MPa;所以答案是:2 MPa.
=2MPa;所以答案是:2 MPa.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
KW/10﹣14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因:
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为mol/L
③10℃时纯水的电离平衡常数为 .