题目内容
下列判断中一定正确的是
| A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强 |
B.若M+和 的核外电子层结构相同,则原子半径:R>M 的核外电子层结构相同,则原子半径:R>M |
| C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则酸性:X>Y |
| D.若X、Y是同主族元素,且原子序数:X>Y,则非金属性:X>Y |
A
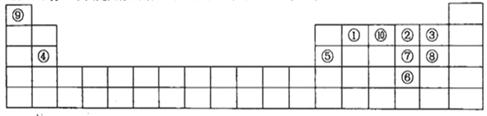
A、D选项,X在Y的下面,金属性强,非金属性弱,A正确,D错误;依据“阴上阳下”规律可确定M、R的大致位置如图 ,可知B选项错误;C选项,气态氢化物的稳定性与非金属性有关,错误。
,可知B选项错误;C选项,气态氢化物的稳定性与非金属性有关,错误。
 ,可知B选项错误;C选项,气态氢化物的稳定性与非金属性有关,错误。
,可知B选项错误;C选项,气态氢化物的稳定性与非金属性有关,错误。
练习册系列答案
相关题目
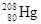 ,它的中子数为:
,它的中子数为: W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。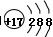 ,则该元素在周期表中位于第三周期、ⅥA族
,则该元素在周期表中位于第三周期、ⅥA族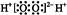
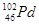 和
和 互为同位素
互为同位素