题目内容
燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解液为强碱溶液。下列关于甲烷燃料电池的说法正确的是( )
| A.负极反应为CH4+10OH-→CO32-+7H2O+8e- |
| B.负极反应为O2+2H2O+4e-→4OH- |
| C.随着放电进行,溶液中的阳离子向负极移动 |
| D.随着放电进行,溶液的PH不变 |
A
解析试题分析:A、燃料电池中燃料作负极,所以甲烷燃料电池中甲烷在负极发生氧化反应,结合电解质溶液,电极反应式为CH4+10OH-→CO32-+7H2O+8e-,正确;B、O2+2H2O+4e-→4OH-是正极反应,错误;C、随着放电进行,溶液中的阳离子向正极移动,错误;D、随着放电进行,氢氧根离子浓度减小,溶液的pH减小,错误,答案选A。
考点:考查燃料电池的反应原理,电极反应式的判断,溶液pH的判断

某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ,直到最后加入一滴盐酸后,溶液由 色变为 ,且 为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |

(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
依据上表数据求得NaOH溶液的物质的量浓度为 。
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200oC左右供电。电池总反应为:C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是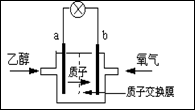
| A.a极为电池的正极 |
| B.电池工作时电流由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) ,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据电镀原理,钢芯镀镍时,钢芯应该做
| A.正极 | B.负极 | C.阳极 | D.阴极 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )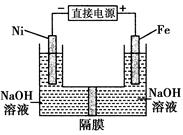
| A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+ |
| B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH- |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
下图为一原电池的结构示意图,下列说法中,错误的是 
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
