题目内容
6.有机物甲分子式为C11H14O2,在酸性条件下水解生成乙和丙,丙遇FeCl3溶液显色,丙的相对分子质量比乙大20,甲的结构有( )| A. | 3种 | B. | 4种 | C. | 8 种 | D. | 6 种 |
分析 丙遇FeCl3溶液显紫色,这说明丙分子中含有酚羟基.然后结合水解反应的原理解题.
解答 解:C11H14O2的不饱和=$\frac{2×11+2-14}{2}$=5,在酸性条件下水解生成乙和丙,丙遇FeCl3溶液显紫色,说明丙分子中含有酚羟基.则甲含有1个苯环、1个酯基,且为羧酸与酚形成的酯,设乙的相对分子质量是x,则x+x+20=178+18,解得x=88,所以乙是丁酸,丙是甲基苯酚(包括邻、间、对),丁酸有2种,故符合条件的有机物甲的结构有2×3=6种,
故选D.
点评 本题考查有机物结构确定及同分异构体种类判断,为高频考点,侧重考查学生的分析能力,正确判断酸、醇结构是解本题关键,注意题中限制性条件,知道饱和一元醇、饱和一元酸的通式,题目难度中等.

练习册系列答案
相关题目
16.下列离子方程式不正确的是( )
| A. | 铁与稀硫酸反应:Fe+2H+═Fe 2++H2↑ | |
| B. | 氯气通入水中:Cl2+2H2O?H++Cl-+HClO | |
| C. | 澄清石灰水中通入少量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
17.随着核电荷数的递增,卤族元素的性质递变规律正确的是( )
①单质颜色加深 ②单质沸点升高
③单质氧化性增强 ④离子半径增大
⑤气态氢化物稳定性增强 ⑥氢化物水溶液的酸性增强.
①单质颜色加深 ②单质沸点升高
③单质氧化性增强 ④离子半径增大
⑤气态氢化物稳定性增强 ⑥氢化物水溶液的酸性增强.
| A. | ①②④⑥ | B. | ④⑤⑥ | C. | ①②③ | D. | ①②③④⑤⑥ |
14.某温度下,容积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)?2Z(g)+W(s)+Q,下列叙述正确的是( )
| A. | 加入少量W,v(逆)增大 | B. | 压强不变时,反应达到平衡状态 | ||
| C. | 升高温度,v(逆)、v(正)都增大 | D. | 平衡后加入X,X转化率增大 |
1.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
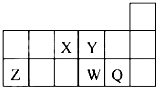

| A. | 元素X与元素Z的正化合价之和的数值等于8 | |
| B. | 原子半径的大小顺序为rX>rY>rZ>rW>rQ | |
| C. | Y和Z形成了共价化合物 | |
| D. | 元素W周期表中的位置是第三周期,第VI主族 |
11.下列规律正确的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | S的非金属性强于P,H2SO3比H3PO4的酸性强 | |
| C. | Al的原子序数比O的大,Al3+的离子半径比O2-的离子半径小 | |
| D. | H2S的相对分子质量比H2O大,H2S的沸点比H2O高 |
18.下面有关Fe(OH)3胶体的说法错误的是( )
| A. | Fe(OH)3胶体可用将FeCl3饱和溶液滴入沸水的方法来制备 | |
| B. | Fe(OH)3胶体电泳时,可以观察到阳极颜色加深 | |
| C. | 向 Fe(OH)3胶体中逐滴滴加稀盐酸,现象是先产生红褐色沉淀后沉淀溶解 | |
| D. | 不断搅拌Fe(OH)3胶体,溶液会变浑浊 |
16.PPA是盐酸苯丙醇胺(pheng propanolamine的缩写),从其名称看,关于其有机成分的分子结构说法正确的是( )
| A. | 可能含-OH、-C6H5 | B. | 一定含-OH、-C6H5、-NH2 | ||
| C. | 可能-C6H5、-COOH | D. | 一定含-COOH、-C6H5、-NH2 |
 或
或 .
.