题目内容
诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:
①2MoS2 + 7O2=== 2MoO3 + 4SO2; ②MoO3 + 2NH3·H2O === (NH4)2MoO4 + H2O; ③(NH4)2MoO4 + 2HCl ===== H2MoO4↓ + 2NH4Cl;④ H2MoO4==== MoO3 + H2O;
⑤用还原剂将MoO3,还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一釉强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
|
⑤用还原剂将MoO3,还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一釉强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
B
A、因为产生SO2,不能直接排
B、根据反应②,能与碱性的氨气反应,所以是酸性氧化物
C、根据反应③,所以应该是弱酸
D、MoO3中Mo由+6价变为0价,用H2还原,H从0变为 + 1,需要3H2;用CO还原,C从 + 2变为 + + 4,需要3CO;用Al还原,Al从0变为 + 2,需要2Al。
B、根据反应②,能与碱性的氨气反应,所以是酸性氧化物
C、根据反应③,所以应该是弱酸
D、MoO3中Mo由+6价变为0价,用H2还原,H从0变为 + 1,需要3H2;用CO还原,C从 + 2变为 + + 4,需要3CO;用Al还原,Al从0变为 + 2,需要2Al。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
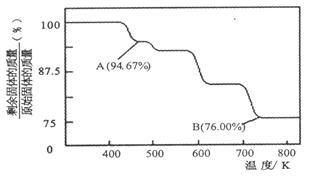
 Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。
Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。
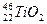 、
、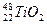 、
、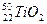 互为同位素
互为同位素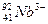 原子核内有51个中子,核外有41个电子
原子核内有51个中子,核外有41个电子
 a2CO3溶液,试说明前后浓度不同的原因:
a2CO3溶液,试说明前后浓度不同的原因: