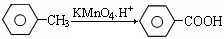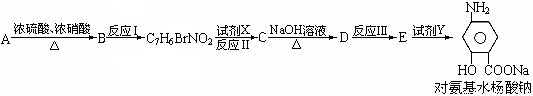题目内容
按要求回答问题
①配平下面的化学方程式,并标明电子转移的方向和数目
②该反应中被还原的HNO3与未被还原的HNO3的物质的量之比为
③上述反应的产物NH4NO3受热分解生成N2、H2O、HNO3,该分解反应中氧化产物与还原产物的质量比为
④Fe(NO3)3溶液能使淀粉碘化钾试纸变蓝色,写出该反应的离子方程式
①配平下面的化学方程式,并标明电子转移的方向和数目
8
8
Fe+30
30
HNO3=8
8
Fe(NO3)3+3
3
NH4NO3+9
9
H2O②该反应中被还原的HNO3与未被还原的HNO3的物质的量之比为
1:9
1:9
.如有1molHNO3被还原,则转移电子8
8
mol,生成NH4NO3质量为80
80
g.③上述反应的产物NH4NO3受热分解生成N2、H2O、HNO3,该分解反应中氧化产物与还原产物的质量比为
5:3
5:3
.④Fe(NO3)3溶液能使淀粉碘化钾试纸变蓝色,写出该反应的离子方程式
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
.分析:①根据氧化还原反应中得失电子数相等配平方程式.
②根据反应中硝酸的作用计算其比值;根据被还原的硝酸与转移电子之间的关系式计算被还原的硝酸.
③先写出反应方程式,根据化合价的变化判断氧化产物和还原产物.
④铁离子有氧化性,碘离子有还原性,导致铁离子和碘离子发生氧化还原反应.
②根据反应中硝酸的作用计算其比值;根据被还原的硝酸与转移电子之间的关系式计算被还原的硝酸.
③先写出反应方程式,根据化合价的变化判断氧化产物和还原产物.
④铁离子有氧化性,碘离子有还原性,导致铁离子和碘离子发生氧化还原反应.
解答:解:①该反应中铁元素的化合价变化为0→+3,所以一个铁原子失去3个电子,氮元素的化合价变化为+5→-3,所以一个参加氧化还原反应的硝酸根离子得到8个电子,所以得失的最小公倍数是24,所以铁的计量数是8,硝酸铵的计量数是3,其它元素根据原子守恒进行配平,所以该方程式为:8Fe+30HNO3=8 Fe(NO3)3+3 NH4NO3+9 H2O.
故答案为:8;30;8;3;9.
②8Fe+27 HNO3+3HNO3(氧化剂)=8 Fe(NO3)3+3 NH4NO3+9 H2O.
所以被还原的硝酸和未被还原的硝酸物质的量之比=3:27=1:9;
设转移电子为xmol;生成硝酸铵的质量为yg.
8Fe+27 HNO3+3HNO3(氧化剂)=8 Fe(NO3)3+3 NH4NO3+9H2O 转移电子
3mol 240g 24mol
1mol yg xmol
x=8,y=80
故答案为:1:9;8;80.
③硝酸铵分解的方程式为:5NH4NO3
4N2↑+9H2O+2HNO3,该反应中氧化产物和还原产物都是氮气,一个铵根离子失去3个电子生成,一个参加氧化还原反应的硝酸根离子得到5个电子,得失电子的最小公倍数是15,所以铵根离子的个数与参加氧化还原反应的硝酸根离子的个数是5:3,所以氧化产物和还原产物的质量之比为5:3.
故答案为:5:3.
④铁离子有氧化性,碘离子有还原性,所以铁离子和碘离子能发生氧化还原反应;Fe(NO3)3溶液能使淀粉碘化钾试纸变蓝色,说明有碘单质生成,同时铁离子被还原成二价铁离子,所以发生的离子方程式为2Fe3++2I-=2Fe2++I2.
故答案为:2Fe3++2I-=2Fe2++I2
故答案为:8;30;8;3;9.
②8Fe+27 HNO3+3HNO3(氧化剂)=8 Fe(NO3)3+3 NH4NO3+9 H2O.
所以被还原的硝酸和未被还原的硝酸物质的量之比=3:27=1:9;
设转移电子为xmol;生成硝酸铵的质量为yg.
8Fe+27 HNO3+3HNO3(氧化剂)=8 Fe(NO3)3+3 NH4NO3+9H2O 转移电子
3mol 240g 24mol
1mol yg xmol
x=8,y=80
故答案为:1:9;8;80.
③硝酸铵分解的方程式为:5NH4NO3
| ||
故答案为:5:3.
④铁离子有氧化性,碘离子有还原性,所以铁离子和碘离子能发生氧化还原反应;Fe(NO3)3溶液能使淀粉碘化钾试纸变蓝色,说明有碘单质生成,同时铁离子被还原成二价铁离子,所以发生的离子方程式为2Fe3++2I-=2Fe2++I2.
故答案为:2Fe3++2I-=2Fe2++I2
点评:本题考查了氧化还原反应的配平、氧化产物和还原产物的比等知识点,难点是③中氧化产物和还原产物质量比,因为反应物只有一种,氧化产物和还原产物是同一种物质,所以能正确判断反应方程式中作氧化剂的硝酸根离子数是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



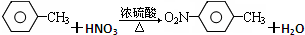
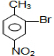


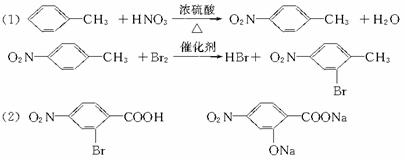
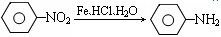 (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)