题目内容
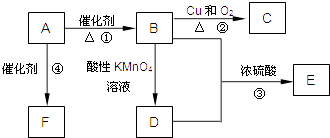
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的__区;溴的价电子排布式为__.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是__.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__.
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3__ H5IO6(填“>”、“<”或“=”).
(5)已知ClO2﹣为角型,中心氯原子周围有四对价层电子.写出一个ClO2﹣的等电子体__.
(6)图3为碘晶体晶胞结构.有关说法中正确的是__.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__.
【答案】 p 4s24p5 氢键 I < Cl2O、OF2等 AD ![]()
【解析】(1) 根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5;(2)HF分子之间存在氢键,使氢氟酸分子缔合;(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子;(4)H5IO6(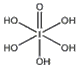 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3;(5)ClO2-中心氯原子的价层电子对数n=2+
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3;(5)ClO2-中心氯原子的价层电子对数n=2+![]() =4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等;(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,选项A正确;B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,选项B错误;C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,选项C错误;D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,选项D正确;答案选AD;(7)该晶胞中含有钙离子个数=8×
=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等;(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,选项A正确;B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,选项B错误;C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,选项C错误;D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,选项D正确;答案选AD;(7)该晶胞中含有钙离子个数=8×![]() +6×
+6×![]() =4,氟离子个数为8,则晶胞体积V=a3,CaF2密度为=
=4,氟离子个数为8,则晶胞体积V=a3,CaF2密度为=![]() =
=![]() =ρ,则CaF2的相对分子质量M=
=ρ,则CaF2的相对分子质量M=![]() 。
。

 阅读快车系列答案
阅读快车系列答案