题目内容
下述实验能达到预期目的的是
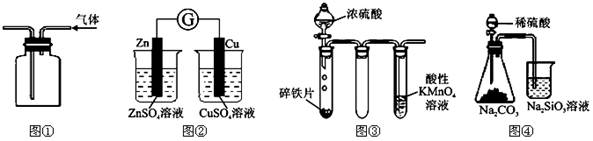
| 编号 | 实验内容 | 实验目的 |
| A | 将CO2(含HC1杂质)通入饱和NaHCO3溶液中 | 除去HC1 |
| B | 向做完银镜反应后的试管中加入稀氨水 | 除去试管内残留物 |
| C | 向做完淀粉水解后的溶液中直接加入新制的Cu(OH)2,并加热 | 检验淀粉是否水解 |
| D | 将少量FeC12试样加水溶解,加稀硝酸酸化,再滴加KSCN溶液 | 检验FeCl2是否变质 |
A
试题分析:盐酸的酸性比碳酸强,则碳酸氢钠与氯化氢能反应,生成氯化钠、水和二氧化碳气体,二氧化碳不溶于饱和碳酸氢钠,故A正确;Ag是金属活动顺序表中氢后的不活泼金属,不溶于非氧化性酸和碱,能溶于硝酸,一般用稀硝酸溶解,反应生成硝酸银、一氧化氮和水,故B错误;淀粉在酸催化下水解的最终产物是葡萄糖,葡萄糖在碱性条件下与新制氢氧化铜共热,能反应生成砖红色沉淀,因此水解液中应该先加入氢氧化钠溶液调溶液pH至碱性,再加入少量新制氢氧化铜,加热3-5分钟,若产生砖红色沉淀,说明淀粉已经水解,故C错误;硝酸能使亚铁离子氧化为铁离子,干扰检验,因此不能加稀硝酸酸化,应直接加入硫氰化钾溶液检验,若溶液变红,说明氯化亚铁溶液已经变质,故D正确。

练习册系列答案
相关题目