题目内容
将足量CO2分别通入下列各溶液中,所含离子仍能大量共存的是( )
| A.NH4+ 、Al3+ 、SO42-、H+ | B.Na+ 、CH3COO- 、C6H5O- 、HCO3- |
| C.Na+、ClO- 、SO42-、Cl- | D.K+、AlO2-、Cl- 、NO3- |
A
解析试题分析:A组离子通入CO2后能够大量共存,A正确;B、C组离子通入CO2后,强酸制弱酸原理C6H5O- 、ClO-不能大量共存;D组离子通入CO2后有大量白色沉淀生成;故选A。
考点:本题考查的是离子共存问题。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应的离子方程式正确的是
| A.往NaAlO2溶液中通入过量CO22AlO2-+ CO2 + 3H2O=2Al(OH)3↓ + CO32- |
| B.Na2SiO3溶液与稀醋酸混合 SiO32-+ 2H+=H2SiO3↓ |
| C.钠与CuSO4溶液反应 2Na + Cu2+=Cu + 2Na+ |
| D.往Na2SO3溶液中滴加双氧水 H2O2 + SO32-=SO42-+ H2O |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl- |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- |
| D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
室温时,下列各组离子在指定溶液中可以大量共存的是( )
| A.由水电离出的c(H+)=10-12mol/L的溶液中:Na+、Ba2+、HCO3—、Cl- |
| B.无色透明溶液中:K+、Cu2+、SO42—、Na+ |
| C.含有大量AlO2—的溶液中:Na+、OH-、Cl-、CO32— |
| D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO42— |
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是 ( )。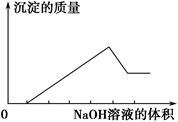
| A.①②⑤ | B.①③④ | C.②⑥⑦ | D.①②④⑥ |
下列说法中不正确的是
| A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B.在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子。已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32- |
| C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 |
| D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
下列溶液中,一定能大量共存的粒子组是( )
| A.pH=1的溶液中:K+、Cr2O72—、CH3CH2OH、SO32— |
| B.含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42— |
| C.加入Al能放出H2的溶液中:K+、NH4+、NO3—、Cl- |
| D.水电离的c(H+)=10-12 mol/L的溶液中:K+、Ba2+、NO3—、I- |
向100 mL 0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
B.a→b段发生反应的离子方程式是:S +Ba2+ +Ba2+ BaSO4↓ BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 Ml |