题目内容
20.下列说法正确的是( )| A. | 升高温度均可以使氨水、氯化铵溶液中c(NH4+)增大 | |
| B. | H2O是一种弱电解质 | |
| C. | 用托盘天平称量NaOH固体时,需在左右托盘上各方一块质量相等的滤纸 | |
| D. | 用25mL滴定管量取25.00mLNaOH溶液时,需将调好零点的滴定管中所有液体放出 |
分析 A.升高温度NH4+水解程度增大,使氯化铵溶液中c(NH4+)减小;
B.H2O只能部分电离,是一种弱电解质;
C.由于氢氧化钠容易吸水,且腐蚀性强,所以用托盘天平称量NaOH固体时,需要在烧杯中进行;
D.滴定管的0刻度下面还有一段空间没有刻度,所以用25mL滴定管量取25.00mLNaOH溶液时,需将调好零点的滴定管中液体放出到0刻度即可;
解答 解:A.升高温度NH4+水解程度增大,使氯化铵溶液中c(NH4+)减小,故A错误;
B.H2O只能部分电离,是一种弱电解质,故B正确;
C.由于氢氧化钠容易吸水,且腐蚀性强,所以用托盘天平称量NaOH固体时,需要在烧杯中进行,故C错误;
D.滴定管的0刻度下面还有一段空间没有刻度,所以用25mL滴定管量取25.00mLNaOH溶液时,需将调好零点的滴定管中液体放出到0刻度即可,故D错误;
故选B.
点评 本题主要考查了盐类的水解、弱电解质、实验基本操作等,难度不大,涉及知识点较多,答题时注意基础知识的灵活运用.

练习册系列答案
相关题目
10.Mg和SiO2在高温下反应生成MgO和Mg2Si.下列说法正确的是( )
| A. | 微粒的半径:Si>Mg | B. | 氧元素不存在同素异形体 | ||
| C. | Mg的还原性强于Si | D. | 该反应是置换反应,镁元素被氧化 |
11.下列反应符合图示的是( )


| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 黑火药爆炸 | D. | 用焦炭制水煤气 |
15.碳酸铰[(NH4)2CO3]在室温下就能自发地分解产生氨气,下列说法正确的是( )
| A. | 碳酸盐都不稳定,都能自发分解 | |
| B. | 碳酸铰分解是因为进行了加热的操作 | |
| C. | 碳酸铰分解是吸热反应,此反应不应该自发进行,必须借助外力才能进行 | |
| D. | 碳酸铰分解是因为生成了易挥发的气体,使体系的熵增大 |
5.如图实验装置或对实验现象的描述正确的是( )
| A. |  分馏装置 | B. | 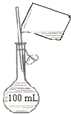 配制150 mL 0.10 mol•L-1盐酸 | ||
| C. |  烧瓶内溶液变蓝色 | D. |  出现砖红色沉淀 |
12.完全中和24.6g二元酸H2A,消耗烧碱24g,则H2A的相对分子质量是( )
| A. | 42 | B. | 82 | C. | 162 | D. | 84 |
9.实验室中,要使NaAlO2溶液中的铝全部沉淀出来,最适宜选用的试剂是( )
| A. | HNO3 | B. | 盐酸 | C. | KOH溶液 | D. | 通入CO2气体 |
17.自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题.
(1).已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2).反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是B
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO)
B.c(NO2)=c(NO)
C.O2的物质的量不变
D.混合气体的密度不变
E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).
(1).已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2).反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) | 0 | 10 | 20 | 25 | 30 |
| 条件A[n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
| 条件B[n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO)
B.c(NO2)=c(NO)
C.O2的物质的量不变
D.混合气体的密度不变
E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).