题目内容
【题目】在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____区,其基态原子价电子排布式为________。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____,与CN-互为等电子体的粒子有_____、________(写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________.中心原子杂化方式为________;HOCH2CN中元素电负性由大到小的顺序_______,1 mol HOCH2CN分子中,含有σ键的数为_________。
(4)ZnS和HgS晶体在岩浆中先晶出的是________,其原因是___________。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
【答案】 ds 3d104s2 ![]() CO N2 平面三角形 sp2 O>N>C>H 6NA ZnS Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能
CO N2 平面三角形 sp2 O>N>C>H 6NA ZnS Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能 ![]() ×1030
×1030
【解析】(1)Zn为30号元素,价电子排布式为3d104s2,在元素周期表中位于ds区,故答案为:ds;3d104s2;
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子为C原子,基态时核外电子的轨道表示式为![]() ,与CN-互为等电子体的粒子有CO和N2,故答案为:
,与CN-互为等电子体的粒子有CO和N2,故答案为:![]() ;CO和N2;
;CO和N2;
(3)甲醛分子中的C原子是sp2杂化,立体构型为平面三角形,根据电负性的变化规律,同一周期从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,HOCH2CN中元素电负性由大到小的顺序为O>N>C>H,HOCH2CN的结构简式为HOCH2C≡N,1 mol HOCH2CN分子中,含有σ键6mol,故答案为:平面三角形;sp2 ;O>N>C>H;6NA;
(4)Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能,ZnS和HgS晶体在岩浆中先晶出ZnS,故答案为:ZnS;Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能;
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,根据晶胞结构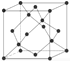 可知,1mol晶胞中含有4molO原子和4molZn原子,1mol晶胞的质量为324g,则该氧化物的密度为
可知,1mol晶胞中含有4molO原子和4molZn原子,1mol晶胞的质量为324g,则该氧化物的密度为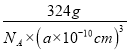 =
=![]() ×1030 g/cm3,故答案为:
×1030 g/cm3,故答案为: ![]() ×1030。
×1030。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案