题目内容
2. 根据下式所示的氧化还原反应设计一个原电池:Fe+2Fe3+═3Fe2+
根据下式所示的氧化还原反应设计一个原电池:Fe+2Fe3+═3Fe2+(1)画出此原电池的装置简图,并注明原电池的正极和负极以及外电路中电子流向.(在装置图中标出)
(2)写出两个电极上的电极反应:
负极:Fe-2e-=Fe2+
正极:2Fe3++2e-=2Fe2+.
分析 由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,以此解答该题.
解答 解:(1)由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,则此原电池的装置图为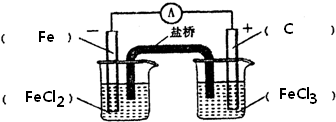 ,
,
故答案为: ;
;
(2)负极为Fe,发生氧化反应生成Fe2+,电极反应式为Fe-2e-=Fe2+,正极为活泼性比铁弱的金属或非金属,可为碳棒,发生还原反应,Fe3+被还原生成Fe2+,电极方程式为2Fe3++2e-=2Fe2+,
答:负极:Fe-2e-=Fe2+;正极:2Fe3++2e-=2Fe2+.
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
10.下列物质中所含分子物质的量最多的是( )
| A. | 56 g N2 | B. | 3.36 L O2 | ||
| C. | 6 g H2 | D. | 3.01×1023个H2SO4分子 |
11.只用水就能鉴别的一组物质是( )
| A. | 乙醛、乙二酸、硝基苯 | B. | 乙醇、乙醛、乙酸 | ||
| C. | 苯、乙酸、四氯化碳 | D. | 苯酚、乙醇、甘油 |
12.某质量分数为10%的NaOH溶液,加热蒸发掉100g水后,得到的溶质质量分数为20%的NaOH溶液80mL,这80mL溶液中溶质的物质的量浓度为( )
| A. | 6.25mol/L | B. | 7mol/L | C. | 7.5mol/L | D. | 12.5mol/L |


 ;
; +CH3CH(OH)CH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH(OH)CH2CH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O; .
.