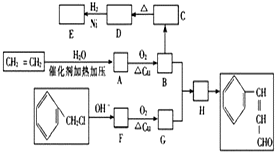
题目内容
10.下列物质中所含分子物质的量最多的是( )| A. | 56 g N2 | B. | 3.36 L O2 | ||
| C. | 6 g H2 | D. | 3.01×1023个H2SO4分子 |
分析 根据n=$\frac{m}{M}$=$\frac{V}{Vm}$计算物质的量.
解答 解:A.56g氮气中物质的量=$\frac{56g}{28g/mol}$=2mol;
B.3.36 L O2的物质的量为$\frac{V}{Vm}$=$\frac{3.36L}{22.4L/mol}$=0.15mol;
C.6 g H2的物质的量为=$\frac{6g}{2g/mol}$=3mol;
D.3.01×1023个H2SO4分子的物质的量为$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,
所以所含分子物质的量最多的是H2,
故选C.
点评 本题考查了分子数多少的计算,灵活运用基本公式是解本题关键,根据N=nNA=$\frac{m}{M}$NA=$\frac{V}{Vm}$NA进行分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途.我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
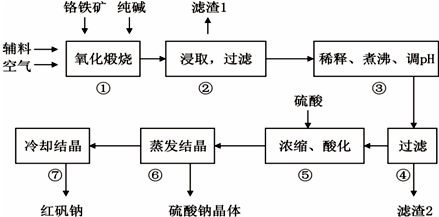
①中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$ 8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是使反应物接触更充分,加快反应速率.
(2)“③”中调节pH至4.7,目的是除去溶液中的AlO2-、SiO32-.
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:2CrO42-+2H+?Cr2O72-+H2O.
(4)“⑦”中采用冷却结晶的方法析出红矾钠,依据是红矾钠的溶解度随温度的降低而减小.
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于2.4×10-4mol•L-1,后续废水处理方能达到排放标准.
②还原法:CrO42-$\underset{\stackrel{绿矾}{→}}{{H}^{+}}$Cr3+$\stackrel{石灰水}{→}$Cr(OH)3.绿矾还原CrO42-的离子方程式为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O.
用该方法处理10m3 CrO42-的物质的量浓度为1.5×10-3 mol•L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是12.51Kg.

①中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$ 8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是使反应物接触更充分,加快反应速率.
(2)“③”中调节pH至4.7,目的是除去溶液中的AlO2-、SiO32-.
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:2CrO42-+2H+?Cr2O72-+H2O.
(4)“⑦”中采用冷却结晶的方法析出红矾钠,依据是红矾钠的溶解度随温度的降低而减小.
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于2.4×10-4mol•L-1,后续废水处理方能达到排放标准.
②还原法:CrO42-$\underset{\stackrel{绿矾}{→}}{{H}^{+}}$Cr3+$\stackrel{石灰水}{→}$Cr(OH)3.绿矾还原CrO42-的离子方程式为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O.
用该方法处理10m3 CrO42-的物质的量浓度为1.5×10-3 mol•L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是12.51Kg.
5.下列实验操作所得结论正确的是( )
| A. | 加入盐酸产生无色气体的溶液中一定含有CO32- | |
| B. | 加入BaCl2溶液产生不溶于稀硝酸的白色沉淀的溶液中一定含有SO42- | |
| C. | 先加足量稀硝酸酸化再加入AgNO3溶液产生白色沉淀的溶液中含有Cl- | |
| D. | 加入无色酚酞溶液仍显无色的溶液一定显酸性 |
19.常温下将一定浓度的某一元酸HA和0.1mol/L NaOH溶液等体积混合后,下列说法正确的是( )
| A. | 若pH=7,c(HA)=0.1 mol/L | |
| B. | 若pH<7,微粒浓度关系可能为:c(Na+)=c(HA)+c(A-) | |
| C. | 若pH>7,c(A-)>c(Na+) | |
| D. | 若pH=12,且HA为强酸时,c(HA)=0.08 mol/L |
 根据下式所示的氧化还原反应设计一个原电池:Fe+2Fe3+═3Fe2+
根据下式所示的氧化还原反应设计一个原电池:Fe+2Fe3+═3Fe2+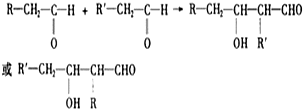

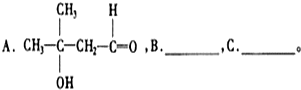
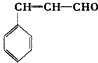 )和丁醇.请在下列合成线路的方框中填上有关物质的结构简式.
)和丁醇.请在下列合成线路的方框中填上有关物质的结构简式.