��Ŀ����
����Ŀ���±���ij��ȤС��ͨ��ʵ���õ���ͬ�������ϡ����������Ӧ��ʵ�����ݣ�
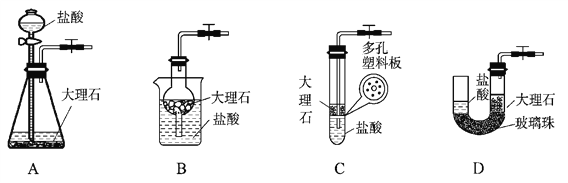
ʵ�� ��� | ���� ����/g | ���� ״̬ | c��H2SO4�� mol/L | ʵ�� �¶�/�� | ������ʧ ��ʱ��/s |
1 | 0.10 | ˿ | 0.7 | 20 | 250 |
2 | 0.10 | ˿ | 1.0 | 20 | 200 |
3 | 0.10 | ��ĩ | 1.0 | 20 | 125 |
4 | 0.10 | ��ĩ | 1.0 | 30 | 50 |
�����������ݣ��ش��������⣺
��1����ʵ��1��2�ɵó��Ľ����ǣ�����Ũ��Խ_____����Ӧ����Խ����
��ʵ��3��4�ɵó��Ľ������¶�Խ_____����Ӧ����Խ�죮
��2���������ۺ�ϡ���ᷴӦ��ȡH2��ʵ������л��Ƴ�����H2�������V����ʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�� �Է����ж�OE�Ρ�EF�Ρ�FG�Ρ�GH�η�Ӧ���ʣ��ֱ���v ��OE����v ��EF����v ��FG����v ��GH����ʾ�����ʱ����______��
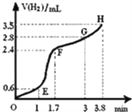
A��v ��OE�� B��v ��EF��C��v ��FG�� D��v ��GH��
��1min�ڷ�Ӧ������ԭ���ǣ�_________��һ��ʱ���Ӧ���Լӿ��ԭ����_____��
���𰸡� С �� B �¶Ƚϵ� ��Ӧ���ȣ��¶�����
�������������������1����ʵ��1��2Ψһ�ı����������Ũ�ȣ�����Ũ�ȴ�ķ�Ӧʱ��̣���ʵ��3��4Ψһ�ı������¶����¶ȸߵķ�Ӧʱ��̣���2���ٸ������ʶ���![]() �������ڸ���Ӱ�����ʵ����ط�����
�������ڸ���Ӱ�����ʵ����ط�����
��������1����ʵ��1��2Ψһ�ı����������Ũ�ȣ�����Ũ�ȴ�ķ�Ӧʱ��������Ը���ʵ��1��2�ɵó��Ľ����ǣ�����Ũ��ԽС����Ӧ����Խ������ʵ��3��4Ψһ�ı������¶����¶ȸߵķ�Ӧʱ��������Ը���ʵ��3��4�ɵó��Ľ������¶�Խ�ߣ���Ӧ����Խ������2���ٸ������ʶ���![]() ����λʱ������������Խ�࣬��Ӧ����Խ�죬����EF�η�Ӧ������죬��ѡB���ڸ÷�Ӧ���ȣ���Һ�¶����ߣ���ʵ�������ʹ��Ӧ���ʼӿ���������¶ȣ�����1min�ڷ�Ӧ������ԭ�����¶ȵͣ�һ��ʱ���Ӧ���Լӿ��ԭ���ǣ���Ӧ���ȣ��¶����ߡ�
����λʱ������������Խ�࣬��Ӧ����Խ�죬����EF�η�Ӧ������죬��ѡB���ڸ÷�Ӧ���ȣ���Һ�¶����ߣ���ʵ�������ʹ��Ӧ���ʼӿ���������¶ȣ�����1min�ڷ�Ӧ������ԭ�����¶ȵͣ�һ��ʱ���Ӧ���Լӿ��ԭ���ǣ���Ӧ���ȣ��¶����ߡ�

 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�