题目内容
【题目】某元素基态原子最外层的电子排布式如下,其中能表示该元素一定为主族元素的是( )
A.3s23p6B.ns2C.4s24p1D.4s1
【答案】C
【解析】
A. 3s23p6为Ar元素,0族元素,不是主族,A不符合题意;
B. ns2可以表示第ⅡA族和大多数副族元素,B不符合题意;
C. 4s24p1最外层三个电子,在第四周期第ⅢA族,为Ga元素,C符合题意;
D. 4s1可以表示K、Cr、Cu,K在主族,Cr、Cu在副族,D不符合题意;
答案选C。

【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________________。
(2)操作I需要的玻璃仪器主要有:烧杯、_______________,操作Ⅱ的名称是___________________。
(3)操作Ⅲ的主要过程可能是___________________________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
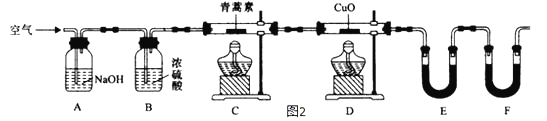
①装置E中盛放的物质是__________________,装置F中盛放的物质是____________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______________________。
③用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的最简式是_____________________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_________(填字母)具有相同的性质。
A.乙醇B.乙酸C.乙酸乙酯D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图所示:由下图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为__________________。

A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s |
1 | 0.10 | 丝 | 0.7 | 20 | 250 |
2 | 0.10 | 丝 | 1.0 | 20 | 200 |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)①实验1、2可得出的结论是,硫酸浓度越_____,反应速率越慢;
②实验3、4可得出的结论是温度越_____,反应速率越快.
(2)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是______.
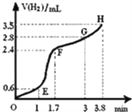
A.v (OE) B.v (EF)C.v (FG) D.v (GH)
②1min内反应较慢的原因是:_________;一段时间后反应明显加快的原因是_____.

