题目内容
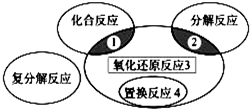
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
A.2H2+O2
| ||||
B.CuO+CO
| ||||
C.2NaHCO3
| ||||
| D.Zn+H2SO4=ZnSO4+H2↑ |

A、反应是氧化还原反应,也是化合反应,不属于区域3,故A错误;
B、反应是氧化还原反应,不是置换反应,不是化合反应,不是分解反应,属于区域3,故B正确;
C、反应不是氧化还原反应,也是分解反应,不属于区域3,故C错误;
D、该反应是氧化还原反应,但又是置换反应,不属于区域3,故D错误.
故选B.
B、反应是氧化还原反应,不是置换反应,不是化合反应,不是分解反应,属于区域3,故B正确;
C、反应不是氧化还原反应,也是分解反应,不属于区域3,故C错误;
D、该反应是氧化还原反应,但又是置换反应,不属于区域3,故D错误.
故选B.

练习册系列答案
相关题目

 或HOCOOH
或HOCOOH
 (2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
(2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.