题目内容
将0.1mol/LNaOH和0.1mol/LNH4CI溶液等体积混合后,离子浓度大小正确的次序是:
A C(Na+)>C(CI-)>C(OH-)>C(H+)
B、C(Na+)=C(CI-)>C(OH-)>C(H+)
C、C(Na+)=C(CI-)>C(H+)>C(OH-)
D、C(CI-)>C(Na+)>C(OH-)>C(H+)
A C(Na+)>C(CI-)>C(OH-)>C(H+)
B、C(Na+)=C(CI-)>C(OH-)>C(H+)
C、C(Na+)=C(CI-)>C(H+)>C(OH-)
D、C(CI-)>C(Na+)>C(OH-)>C(H+)
B
由NaOH+NH4CI=NaCl+NH3.H2O,得:反应后,变为等浓度的NaCl、NH3.H2O 溶液
NaCl=Na++Cl- (完全电离) NH3.H2O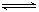 NH4++OH- (部分电离)
NH4++OH- (部分电离)
且溶液呈碱性,所以:C(OH-)>C(H+)
NaCl=Na++Cl- (完全电离) NH3.H2O
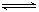 NH4++OH- (部分电离)
NH4++OH- (部分电离)且溶液呈碱性,所以:C(OH-)>C(H+)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 溶液(约1mol/L)、
溶液(约1mol/L)、 溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______________________________.
溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______________________________. 代替
代替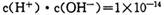
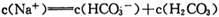
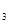 溶液时,往往在FeCl
溶液时,往往在FeCl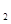 (SO
(SO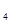 )
)