题目内容
一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是( )
| A.气体甲为SO2和H2的混合物 | B.气体甲中SO2与H2的体积之比为4:1 |
| C.反应中共消耗97.5 g Zn | D.反应中共转移3 mol电子 |
B
解析试题分析:Zn与浓硫酸反应Zn+ 2H2SO4(浓)= ZnSO4+SO2↑+2H2O;随着反应的进行,类型变稀,这时发生反应:Mg+ H2SO4(稀)= ZnSO4+H2↑。A.由于反应后的溶液中c(H+)="0.1" mol/L,含有稀硫酸,所以上述两个反应都发生,得到的气体甲为SO2和H2的混合物。正确。B.假设产生的SO2、H2的物质的量分别是x、y,则x+y="1.5;2x+y=0.1L×18.5" mol/L-1 L×0.1 mol/L÷2.解得x=0.3;Y=1.2所以气体甲中SO2与H2的体积之比为0.3:1.2=1:4。错误。C.根据B的计算可知反应消耗的Zn的物质的量为:x+y=1.5.故反应中共消耗Zn的质量是1.5mol×65g/mol="97.5" g。正确。D.反应中共转移电子的物质的量为1.5mol ×2="3" mol。正确。
考点:考查Zn与浓硫酸反应的情况的知识。

2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
| A.汽车尾气催化转化机理 | B.钢铁生锈机理 |
| C.合成氨工业催化氧化机理 | D.氢氧燃烧电池电极反应机理 |
海带中的碘元素是以I-的形式存在的,为将I-转化成I2并提取出来,设计操作步骤如下:①通入Cl2;②将海带烧成灰,向灰中加水,搅拌;③加CCl4振荡;④过滤;⑤用分液漏斗分液。合理的操作顺序为( )
| A.①③⑤②④ | B.②①③④⑤ | C.②④①③⑤ | D.③①②⑤④ |
将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3- 的物质的量为
| A.0.5a mol | B.2a mol | C.0.1a mol | D.(0.1+a)mol |
下列说法中正确的是 ( )
| A.6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 |
| B.常温下铁、铜均不溶于浓硫酸, 说明常温下铁、铜与浓硫酸均不反应 |
| C.离子化合物中只含离子键 |
| D.中子数为18的氯原子可表示为18Cl |
能符合如下图所示的转化关系的元素是 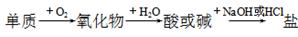
| A.硅 | B.硫 | C.铜 | D.铁 |
下列对有关实验事实的解释或得出的结论合理的是
| 选项 | 实验事实 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 | SO2具有漂白性 |
| B | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| C | 某钾盐溶于盐酸,产生无色无味气体,该气体通入澄清石灰水,有白色沉淀出现 | 该钾盐可能是K2CO3 |
| D | NaI溶液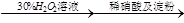 溶液变蓝色 溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
化学与社会、生产、生活密切相关。下列说法正确的是
| A.碳纤维是一种新开发的材料,它属于合成有机高分子化合物 |
| B.对“地沟油”进行分馏可得到汽油 |
| C.漂白粉长期暴露在空气中最后会变质失效 |
| D.氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
下列说法不正确的是
| A.2013年0点钟声敲响后的几个小时,北京的污染指数从轻度污染上升为重度污染,主要污染为PM2.5污染,看来烟花爆竹的燃放,可加重PM2.5污染 |
| B.催化剂之所以能加快反应速率,是因为催化剂能降低反应的活化能 |
| C.氨气的水溶液氨水可以导电,因此氨气是电解质 |
| D.大量燃烧含硫燃料是形成酸雨的主要原因 |