题目内容
8.反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率$\overline{V}$(X)(反应物的消耗速率或产物的生成速率)可表示为( )| A. | $\overline{V}$(NH3)=0.010 mol•L-1•s-1 | B. | $\overline{V}$(O2)=0.001 0 mol•L-1•s-1 | ||
| C. | $\overline{V}$(NO)=0.001 0 mol•L-1•s-1 | D. | $\overline{V}$(H2O)=0.045 mol•L-1•s-1 |
分析 半分钟后,$\overline{V}$(H2O)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,再结合同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比计算其它物质的平均反应速率.
解答 解:半分钟后,$\overline{V}$(H2O)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,再结合同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比得,
A.$\overline{V}$(NH3)=$\frac{2}{3}$×0.0015mol•L-1•s-1=0.0010 mol•L-1•s-1,故A错误;
B.$\overline{V}$(O2)=$\frac{5}{6}$×0.0015mol•L-1•s-1=0.00125 mol•L-1•s-1,故B错误;
C.$\overline{V}$(NO)=$\frac{2}{3}$×0.0015mol•L-1•s-1=0.001 0 mol•L-1•s-1,故C正确;
D.根据以上分析知,$\overline{V}$(H2O)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,故D错误;
故选C.
点评 本题考查化学反应速率的有关计算,明确反应速率与其计量数之间关系是解本题关键,有时反应速率还以比较反应快慢方式考查,题目难度不大.

练习册系列答案
相关题目
18.下列化学用语和叙述正确的是( )
| A. | M与N是同素异形体,由M=N;△H=+119kJ/mol可知,N比M稳定 | |
| B. | Na2O2的电子式: | |
| C. | 表示乙炔“燃烧热”对应的热化学方程式:C2H2 (g)+$\frac{5}{2}$O2 (g)═△2CO2 (g)+H2O(g)△H=-1 256kJ/mol | |
| D. | 葡萄糖的实验式:CH2O |
16.下列化合物电子式书写正确的是( )
| A. | 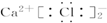 | B. | 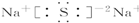 | C. | 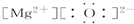 | D. | 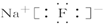 |
3.以下实验或操作不能达到目的是( )
| A. | 用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 | |
| B. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| C. | 用酸式滴定管量取8.00mL1mol/L的KMnO4溶液 | |
| D. | 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,必须重新配制 |
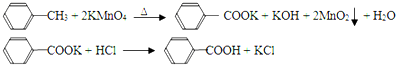
13.某有机物的结构简式为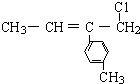 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )
 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 加聚反应 |
20.冶铁的原料为铁矿石、焦炭、空气和石灰石.测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素).若每生产1000kg生铁排放煤气2400m3,则至少需要补充空气?(空气体积分数:氮气0.8 氧气0.2),气体都在同温同压下测定.( )
| A. | 1392m3 | B. | 1740m3 | C. | 1920m3 | D. | 2304m3 |
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
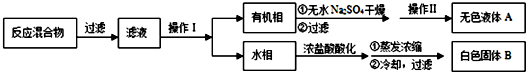
18.化学是一门以实验为基础的学科,化学研究离不开化学实验,下列有关化学实验的说法正确的是( )
| A. | 实验室制取乙烯时用酒精灯加热,使反应体系的温度迅速上升到170℃是为了加快反应速率 | |
| B. | 提纯苯甲酸的实验中,粗苯甲酸全部溶解后不用再向烧杯中加入少量蒸馏水 | |
| C. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞作指示剂比选用甲基橙作指示剂时带来的误差要小一些 | |
| D. | 要检验某混合气体中含有乙烯,可以将气体直接通入到酸性高锰酸钾溶液中,若紫色褪去,则说明含有乙烯 |