题目内容
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
②pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系c(Na+)+c(H+)=c(OH-)+c(HCO3‑)+2c(CO32-)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;
则三者关系为:Ka·Kh=Kw
⑥反应A(g) 2B(g);△H,若正反应的活化能为Ea
kJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为Ea
kJ·mol-1,逆反应的活化能
为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
A.①②③⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
【答案】
B
【解析】
试题分析:①强酸性溶液加水稀释后c(OH-)增大,错误②pH=2的盐酸和pH=1的醋酸,c(H+)之比为1:10,错误③表达式为电荷守恒,正确;④已知:△G=△H-T△S,△G大于0,该反应△S大于0,若不能自发进行反应,则△H大于0,正确;⑤Ka=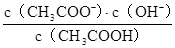 ,Kh=
,Kh=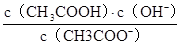 ,所以Ka·Kh=Kw⑥正反应的活化能即反应物断键需要的能量,逆反应的活化能即生成物成键所需要的能量,正确。
,所以Ka·Kh=Kw⑥正反应的活化能即反应物断键需要的能量,逆反应的活化能即生成物成键所需要的能量,正确。
考点:本题考查了溶液PH值的计算,溶液中离子守恒关系,离子积常数的计算等知识。

练习册系列答案
相关题目

 2B(g);△H,若正反应的活化能为Ea
kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea
-Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为Ea
kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则△H =(Ea
-Eb)kJ·mol-1。其归纳正确的是 2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能