题目内容
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)如图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
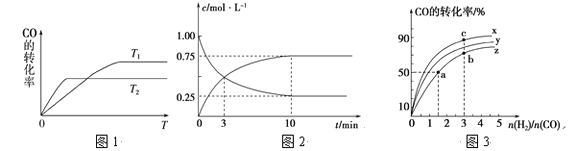
①该反应的焓变ΔH________0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为______________。
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________。
【答案】< > 12 b 270 K1=K2< K3
【解析】
(1)①根据图像信息结合勒夏特列原理判断;
②正反应为放热反应,升高温度,平衡逆向进行,则化学平衡常数减小;利用三段式计算平衡时各量的浓度,再计算K。
③a.容器容积不变,升高温度,平衡逆向移动,CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO的转化率增大,b正确;
c.使用合适的催化剂不会引起化学平衡的移动,CO的转化率不变,c错误;
d.容器容积不变,充入He,使体系总压强增大,各物质的浓度不变,化学平衡不移动,CO的转化率不变,d错误;
(2)反应为放热反应,温度越高CO的转化率越小;化学平衡常数只与温度有关,反应为放热反应,升高温度,平衡常数减小。
(1)①根据图中的信息可知:T2>T1,温度越高CO转化率越小,则反应CO(g)+2H2(g)![]() CH3OH(g)中,降低温度,平衡向右进行,一氧化碳的转化率增大,根据勒夏特列原理,正反应是放热反应,△H<0;
CH3OH(g)中,降低温度,平衡向右进行,一氧化碳的转化率增大,根据勒夏特列原理,正反应是放热反应,△H<0;
②正反应为放热反应,升高温度,平衡逆向进行,则化学平衡常数减小,T2>T1,则K1>K2;在T1温度下,根据图2所示,10min时达到平衡状态,已知CO的浓度为1mol/L,则图像为CO与CH3OH的浓度变化,平衡时,c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初始:1 2 0
反应:0.75 1.5 0.75
平衡:0.25 0.5 0.75
K=0.75/(0.25×0.52)=12;
③a.容器容积不变,升高温度,平衡逆向移动,CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO的转化率增大,b正确;
c.使用合适的催化剂不会引起化学平衡的移动,CO的转化率不变,c错误;
d.容器容积不变,充入He,使体系总压强增大,各物质的浓度不变,化学平衡不移动,CO的转化率不变,d错误;
答案为b;
(2)反应为放热反应,温度越高CO的转化率越小,曲线Z为270℃;化学平衡常数只与温度有关,则K1=K2,反应为放热反应,升高温度,平衡常数减小,则曲线x为230 ℃,K1=K2< K3。

【题目】有关元素W、X、Y、Z的信息如下,请用化学用语完成下列问题:
元素 | 信息 |
W | 所在主族序数与所在周期序数之差为4,其单质在常温下呈黄绿色 |
X | X+的电子层结构与Ne相同 |
Y | 生活中常见的金属,其制品在潮湿的空气中会生锈 |
Z | 地壳中含量最多的金属元素 |
(1)请写出Z元素在周期表中的位置________。请写出Z高价氧化物的水化物与X最高价氧化物水化物反应的离子方程式________。
(2)X在空气中加热,生成一种淡黄色固体,该固体的电子式是________。
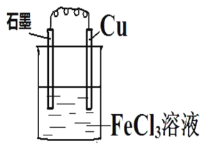
(3)以铜棒、石墨为电极材料,YW3溶液为电解质溶液,形成如图所示的原电池,则该原电池正极的电极反应式为________。如何检验正极反应的产物离子,请简述操作过程及现象________,________。
(4)Y和Z单质混合物质量为3.28g,总物质的量为0.1mol。加入足量盐酸溶解,再加入适量H2O2溶液,然后加入氨水恰好完全沉淀,过滤、洗涤、干燥,得到固体的质量为________g。加入H2O2溶液反应的离子方程式为________。