题目内容
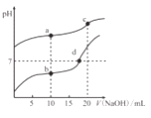
【题目】将cmol/L氨水滴入10mL.0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
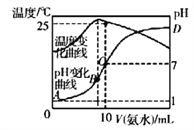
A. c=0.1
B. 25℃时,NH4Cl的水解常数(KA)=(10c-1)×10-7
C. 水的电离程度:B>C>A>D
D. B点:c(NH3·H2O)+c(H+)=c(OH-)
【答案】B
【解析】A、C点时,将10ml cmol/L 氨水滴入10mL.0.1mol/L盐酸中,pH正好等于7,c若等于0.1,应恰好完全反应生成NH4Cl,pH<7,c一定大于0.1,故A错误;B、根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7molL-1,c(NH4+)=c(Cl-)=0.05mol/L,根据N守恒可知:c(NH3H2O)=(0.5c-0.05)mol/L,则25℃时NH4Cl水解常数为:K=![]() =(10c-1)×10-7,故B正确;C、B点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则A、D两点都抑制了水的电离,则B点水的电离程度最大;由于D点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故C错误;D、b点时溶液为NH4Cl溶液,pH<7,则c(H+)>c(OH-),故D错误,质子守恒为:c(NH3H2O)+ c(OH-)= c(H+);故选B。
=(10c-1)×10-7,故B正确;C、B点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则A、D两点都抑制了水的电离,则B点水的电离程度最大;由于D点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故C错误;D、b点时溶液为NH4Cl溶液,pH<7,则c(H+)>c(OH-),故D错误,质子守恒为:c(NH3H2O)+ c(OH-)= c(H+);故选B。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素,其配方如下:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3- | H2PO42- | SO42- | Zn2+ |
培养液浓度( g/L ) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是
A.Ca2+B.SO42-C.Zn2+D.H2PO42-