题目内容
(7分)在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题:
(1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1
(2)在图中画出SO3的物质的量浓度随时间的变化曲线。

(3)在其他条件不变,7min时分别改变下列条件,将改变条件的瞬间正、逆反应速率的变化情况(“增大”、“减小”或“不变”)填入下表空格内:
| 改变的条件 | V正 | V逆 |
| ①增大O2的浓度 | 增大 |
|
| ②减小SO3的浓度 |
| 减小 |
| ③缩小容器的体积 | 增大 |
|
| ④加入V2O5作催化剂 | 增大 |
|
| ⑤压强不变充入He气体 |
| 减小 |
(1)0.03mol/(L.min)
(2)

(3)
| 改变的条件 | V正 | V逆 |
| ①增大O2的浓度 |
| 不变 |
| ②减小SO3的浓度 | 不变 |
|
| ③缩小容器的体积 |
| 增大 |
| ④加入V2O5作催化剂 |
| 增大 |
| ⑤压强不变充入He气体 | 减小 |
|
解析:(1)反应速率通常用单位时间内浓度的变化量来表示,所以用SO2表示的反应速率为![]() 。
。
(2)SO3是生成物,起始浓度为0。由于平衡时SO2的浓度的变化量是0.12mol/L,所以生成的SO3的浓度就是0.12mol/L,因此图像为
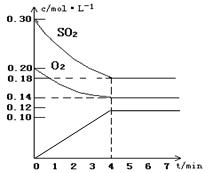
(3)考查外界条件对反应速率的影响。在其它条件不变的情况下,增大反应物浓度或升高温度或增大压强或使用催化剂都能增大反应速率。增大氧气浓度的瞬间,生成物的浓度是不变的,所以逆反应速率瞬间是不变的。减小SO3的浓度的瞬间,反应物的浓度是不变的,所以正反应速率瞬间是不变的。缩小容器的体积,压强增大,因此正逆反应速率均增大。催化剂能同等程度改变正逆反应速率,所以都增大。压强不变,充入氦气,容器容积必然增大,所以物质的浓度一定减小,因此正逆反应速率均减小。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |