��Ŀ����
����Ŀ���������������Ħ���Σ���ѧʽΪx��NH4��2SO4yFeSO4zH2O����������ˮ������ȱ����ƶѪ�ȣ�ijʵ��С����������ķ������ⶨ����ɣ�
��NH4+�����ⶨ����ȡ9.8g��������茶��壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ�������lO%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������lOOmL 1.0molL��1���������Һ���գ�
����������ȡ�½���ƿ����1.0molL��1NaOH����Һ�ζ�ʣ���HCl�����յ�ʱ����50mlNaOH��Һ��
��Fe2+�����ⶨ��������ʵ��������ƿ�м��������3%��˫��ˮ����ַ�Ӧ����ˡ�ϴ�ӡ����յõ�2.0g���壮
�۽ᾧˮ�����ⶨ����ȡ9.8g��������茶��壬������Ϊ15g�������м�����200�棬����һ��ʱ�䣬���ڿ�������ȴ����������Ϊ22.3g���ظ��������ȡ���ȴ���������̣��������γ��������ͬ���ش��������⣺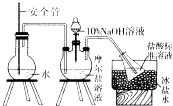
��1��װ���а�ȫ�ܵ�����ԭ���� ��
��2������ˮ�������� ��
��3����NaOH����Һ�ζ�ʣ���HClʱ����ʹ�õ�ָʾ���� ��
��4���ⶨFe2+ʱ������˫��ˮ������Ӧ�Ļ�ѧ����ʽ�� ��
��5������ڲⶨNH4+�����Ĺ����У�����Ԫ�ز��ֱ���������Fe2+�����IJⶨ����С����ޡ���Ӱ�죮
��6�����ݢ١��ڵ����ݣ���Ħ���ξ�����n��NH4+����n��Fe2+����n��SO42�� ��= �� z= ��
��7�����ݢ۵����ݣ����ֽᾧˮ�����ⶨ���ƫ�ͣ���ʵ����̷���������ԭ���� ��
���𰸡�
��1����������ƿ��ѹ������ʱ����ȫ����Һ��������ʹ������ƿƿ��ѹ���ȶ�
��2����ֹ����ӷ�
��3�����Ȼ��̪
��4��2Fe��OH��2+H2O2=2Fe��OH��3
��5����
��6��2��1��2��6
��7����ˮ�����ڿ�������ȴʱ�����˿�����ˮ����
���������⣺��1��������ƿ��Բ����ƿ��ͨ����������ƿ��ѹ������ʱ����ȫ����Һ��������ʹ������ƿƿ��ѹ���ȶ������Դ��ǣ���������ƿ��ѹ������ʱ����ȫ����Һ��������ʹ������ƿƿ��ѹ���ȶ�����2������ˮ�¶Ƚϵͣ�������ȴ��ƿ�е��������Һ����ֹ����ӷ������Դ��ǣ���ֹ����ӷ�����3��ǿ��ζ�ǿ������ü��Ȼ��̪��ָʾ����������NaOH����Һ�ζ�ʣ���HClʱ������ʹ�ü��Ȼ��̪��ָʾ�������Դ��ǣ����Ȼ��̪����4����˫��ˮ��Fe��OH��2������ΪFe��OH��3 �� �䷴Ӧ�ķ���ʽΪ��2Fe��OH��2+H2O2=2Fe��OH��3 �� ���Դ��ǣ�2Fe��OH��2+H2O2=2Fe��OH��3����5���ⶨFe2+�ĺ������ǰ�Fe2+ת��Ϊ���������������յõ���������������Ԫ���غ���㣬�����ڲⶨNH4+�����Ĺ����У�����Ԫ�ز��ֱ���������Fe2+�����IJⶨ��Ӱ�죬���Դ��ǣ��ޣ���6����1.0molL��1NaOH����Һ�ζ�ʣ���HCl�����յ�ʱ����50mlNaOH��Һ������������ʵ���n��HCl��=n��NaOH��=1.0molL��1��0.05L=0.05mol���백����Ӧ������Ϊ1.0molL��1��0.1L��0.05mol=0.05mol�������������ʵ���Ϊ0.05mol����n��NH4+��=0.05mol��
n��Fe2+��=2n��Fe2O3��=2�� ![]() =0.025mol��n��SO42�� ��=
=0.025mol��n��SO42�� ��= ![]() n��NH4+��+n��Fe2+��=
n��NH4+��+n��Fe2+��= ![]() ��0.05mol+0.025mol=0.05mol������n��NH4+����n��Fe2+����n��SO42�� ��=0.05mol��0.025mol��0.05mol=2��1��2����������ݿ�֪9.8gĦ������m��H2O��=9.8g��m��NH4+����m��Fe2+����m��SO42����=9.8g��18��0.05g��56��0.025g��96��0.05g=2.7g����n��H2O��=
��0.05mol+0.025mol=0.05mol������n��NH4+����n��Fe2+����n��SO42�� ��=0.05mol��0.025mol��0.05mol=2��1��2����������ݿ�֪9.8gĦ������m��H2O��=9.8g��m��NH4+����m��Fe2+����m��SO42����=9.8g��18��0.05g��56��0.025g��96��0.05g=2.7g����n��H2O��= ![]() =0.15mol������
=0.15mol������ ![]() =
= ![]() �����z=6�����Դ��ǣ�2��1��2��6����7���ɢ������ݿ�֪m��H2O��=9.8g+15g��22.3g=2.5g���ɢ٢ڼ���õ���ˮ������Ϊ2.7g���ᾧˮ�����ⶨ���ƫ�ͣ���Ϊ�����������м��Ⱥ��ڿ�������ȴʱ�������ˮ������ʣ����������ƫ���������ˮ������ƫС��
�����z=6�����Դ��ǣ�2��1��2��6����7���ɢ������ݿ�֪m��H2O��=9.8g+15g��22.3g=2.5g���ɢ٢ڼ���õ���ˮ������Ϊ2.7g���ᾧˮ�����ⶨ���ƫ�ͣ���Ϊ�����������м��Ⱥ��ڿ�������ȴʱ�������ˮ������ʣ����������ƫ���������ˮ������ƫС��
���Դ��ǣ���ˮ�����ڿ�������ȴʱ�����˿�����ˮ������


