题目内容
6.某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:①取少量溶液加氢氧化钠溶液过程中无沉淀生成②另取少量原溶液,逐滴加入5mL0.2mol•L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失.
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g.
下列说法中正确的是( )
| A. | 该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl- | |
| B. | 该溶液中一定含有K+、AlO2-、CO32-、Cl- | |
| C. | 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) | |
| D. | 可能含有Cl- |
分析 ①加氢氧化钠溶液过程中无沉淀生成,说明溶液中一定不存在A13+、Mg2+;
②另取少量原溶液,逐滴加入5mL0.2mol•L-1盐酸,开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失,产生和溶解的沉淀为氢氧化铝,产生的气体为二氧化碳,说明溶液中存在AlO2-、CO32-,所以一定不存在SiO32-、Ba2+,根据溶液电中性可知,溶液中一定存在K+;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g,沉淀为AgCl,物质的量为:$\frac{0.43g}{143.5g/mol}$≈0.003mol>n(HCl)=0.001mol,所以原溶液中一定存在0.02molCl-,据此进行解答.
解答 解:①向溶液中加氢氧化钠溶液过程中无沉淀生成,说明溶液中一定不存在与氢氧化钠生成沉淀的离子:A13+、Mg2+;②向原溶液中逐滴加入5mL0.2mol•L-1盐酸,开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;滴加盐酸产生和溶解的沉淀为氢氧化铝,气体为二氧化碳,说明原溶液中存在AlO2-和CO32-,所以一定不存在不溶于盐酸的SiO32-和与CO32-反应的Ba2+,再根据溶液电中性可知:溶液中一定存在唯一的阳离子:K+;③在②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g,沉淀为AgCl,物质的量为:$\frac{0.43g}{143.5g/mol}$≈0.003mol;②中加入的氯离子的物质的量为:n(HCl)=0.2mol/L×0.005L=0.001mol<n(AgCl),所以原溶液中一定存在0.02mol Cl-,
A.根据以上分析可知,溶液中一定不存在Ba2+、Mg2+、A13+、SiO32-,一定存在Cl-,故A错误;
B.由分析可知:该溶液中一定含有K+、AlO2-、CO32-、Cl-,故B正确;
C.根据溶液的电中性可以判断,溶液中一定存在K+,不需要通过焰色反应判断K+是否存在,故C错误;
B.根据分析可知,原溶液中一定存在Cl-,故D错误;
故选B.
点评 本题考查了常见离子的检验方法及判断,题目难度中等,注意掌握常见离子的性质及检验方法,本题中钾离子和氯离子的判断为难点,注意根据溶液电中性及生成氯化银的物质的量判断二者的存在情况.

| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
| A. | 除去乙烷中少量的乙烯:通过溴的四氯化碳溶液洗气 | |
| B. | 除去乙酸乙酯中少量的乙酸:先加入氢氧化钠溶液后再分液 | |
| C. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| D. | 除去溴苯中混有的少量苯:加入液溴和铁粉后过滤 |
| A. | 1种 | B. | 3种 | C. | 4种 | D. | 多于4种 |

| A. | 无机物 | B. | 烯烃 | C. | 高分子化合物 | D. | 有机化合物 |
| A. | 汽油 | B. | 浓氨水 | C. | 乙醇 | D. | 溴苯 |
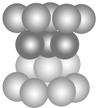
| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
