题目内容
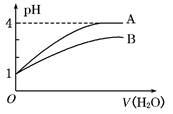
有关常温下pH均为3的醋酸和硫酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
A
醋酸为弱酸,存在电离平衡:CH3COOH CH3COO-+H+,而硫酸为强酸,全部电离为离子。
CH3COO-+H+,而硫酸为强酸,全部电离为离子。
A.在两酸溶液中,溶液中的H+浓度(1×10-3mol·L-1)相同,则OH—浓度(1×10-11mol·L-10也相同,而两种溶液中的OH—全部来自于水的电离,故由水电离出的OH—、H+浓度均为1×10-11mol·L-1,正确
B.由于弱酸存在电离平衡,在稀释过程中促进其电离,故分别加水稀释100倍后,弱酸中+H+反而大,其pH相对较小
C.两溶液中的电荷守恒分别为:c(H+)=c(CH3COO-)+c(OH-)、c(H+)=2c(SO42-)+c(OH-);由于两溶液的OH—、H+浓度均相同,故醋酸中的c(CH3COO-)为硫酸中的c(SO42-)的二倍
D.由于弱酸在与锌反应过程中,不断电离出氢离子补充,故pH相同的两酸弱酸生成H2的体积相对较大
故答案为A
 CH3COO-+H+,而硫酸为强酸,全部电离为离子。
CH3COO-+H+,而硫酸为强酸,全部电离为离子。A.在两酸溶液中,溶液中的H+浓度(1×10-3mol·L-1)相同,则OH—浓度(1×10-11mol·L-10也相同,而两种溶液中的OH—全部来自于水的电离,故由水电离出的OH—、H+浓度均为1×10-11mol·L-1,正确
B.由于弱酸存在电离平衡,在稀释过程中促进其电离,故分别加水稀释100倍后,弱酸中+H+反而大,其pH相对较小
C.两溶液中的电荷守恒分别为:c(H+)=c(CH3COO-)+c(OH-)、c(H+)=2c(SO42-)+c(OH-);由于两溶液的OH—、H+浓度均相同,故醋酸中的c(CH3COO-)为硫酸中的c(SO42-)的二倍
D.由于弱酸在与锌反应过程中,不断电离出氢离子补充,故pH相同的两酸弱酸生成H2的体积相对较大
故答案为A

练习册系列答案
相关题目

 CH3COO―+H+
CH3COO―+H+