题目内容
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充人a mol CO与6 molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②X=___________(用含a、b的式子表示),p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为了T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
【答案】 -566 -107 > ![]() > 4. 5 无法确定 CH3OH+H2O-6e-==CO2↑+6H+
> 4. 5 无法确定 CH3OH+H2O-6e-==CO2↑+6H+
【解析】(1)根据化学方程式及化学键键能数据,△H1=2×958.5+497-2×745×2=-566 kJmol-1;根据盖斯定律,CO(g)+2H2(g) ![]() CH3OH(g)的△H=△H1×
CH3OH(g)的△H=△H1×![]() -△H2×2-△H3=(-566×
-△H2×2-△H3=(-566×![]() +41×2+660)kJmol-1=-107 kJmol-1。
+41×2+660)kJmol-1=-107 kJmol-1。
(2)因为CO(g)+2H2(g) ![]() CH3OH(g) △H=-107 kJmol-1<0,所以温度越高,平衡时CH3OH的含量越低,所以图1中T2>T1,故①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1>t2。②已知a mol CO与b molH2合成甲醇,故投料物质的量之比(用X表示)为:
CH3OH(g) △H=-107 kJmol-1<0,所以温度越高,平衡时CH3OH的含量越低,所以图1中T2>T1,故①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1>t2。②已知a mol CO与b molH2合成甲醇,故投料物质的量之比(用X表示)为: ![]() ;由图2知,投料比相同时,压强为P1的反应氢气平衡转化率高,又因为该反应为气体分子数减小的反应,故P1>P2。③若a=2,b=4,则压强为P1、温度为了T1时,列三段式:
;由图2知,投料比相同时,压强为P1的反应氢气平衡转化率高,又因为该反应为气体分子数减小的反应,故P1>P2。③若a=2,b=4,则压强为P1、温度为了T1时,列三段式:
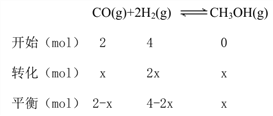
由图1,此条件下平衡时CH3OH的体积分数为40%,所以: ![]() =0.4,解得x=
=0.4,解得x=![]() ,所以平衡时n(CO)=
,所以平衡时n(CO)=![]() mol,n(H2)=
mol,n(H2)=![]() mol,又因为容积为2L,所以CO、H2、CH3OH的平衡浓度分别为:
mol,又因为容积为2L,所以CO、H2、CH3OH的平衡浓度分别为: ![]() molL-1、
molL-1、![]() molL-1、
molL-1、![]() molL-1,故K=
molL-1,故K=![]() =4.5。
=4.5。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体(设为y),此时浓度商=![]() =
=![]() ÷[
÷[![]() ×(
×(![]() )2]=
)2]= ![]() ,与K无法比较大小,不确定平衡向哪个方向移动,故无法确定ν(CH3OH)正与ν(CH3OH)逆的大小。
,与K无法比较大小,不确定平衡向哪个方向移动,故无法确定ν(CH3OH)正与ν(CH3OH)逆的大小。
(3)酸性条件下甲醇燃料电池的总反应式为:CH3OH+![]() O2=CO2+2H2O①,酸性条件下该燃料电池的正极反应式为:
O2=CO2+2H2O①,酸性条件下该燃料电池的正极反应式为: ![]() O2+6H++6e-=3H2O②,①-②得电池负极反应式为:CH3OH+H2O-6e-=CO2↑+6H+。
O2+6H++6e-=3H2O②,①-②得电池负极反应式为:CH3OH+H2O-6e-=CO2↑+6H+。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案


