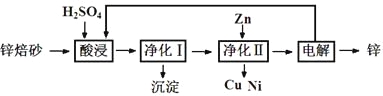
题目内容
【题目】下图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是_______________。
②用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是___________________。
(2)完成下列化学方程式:体现N元素的还原性:
a. 汽车尾气中产生的NO:N2+O2 ![]() 2NO。
2NO。
b. 氨的催化氧化:_______________________。
(3)NO2 易溶于水。标准状况下将体积为V mL的试管充满NO2后倒扣在水中,见下图。
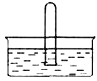
① NO2溶于水的化学方程式是_________。
② 使试管中NO2恰好完全被水吸收需要缓慢通入氧气,通入标准状况下氧气的体积为__________。最终试管中所的硝酸的物质的量浓度为_____________。
③ 为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是_______________.
(4)写出除掉Fe2O3中的SiO2的离子方程式____________________________
写出制取漂白粉的化学方程式________________________________________
【答案】 2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+ 2H2O 氨气易溶于水,使装置中的压强小于外界的压强,引起倒吸 4NH3+5O2
CaCl2 + 2NH3↑+ 2H2O 氨气易溶于水,使装置中的压强小于外界的压强,引起倒吸 4NH3+5O2 ![]() 4NO+6H2O 3NO2+H2O=2HNO3+NO V/4 mL 1/22.4 mol/L 6NO2+8NH3
4NO+6H2O 3NO2+H2O=2HNO3+NO V/4 mL 1/22.4 mol/L 6NO2+8NH3![]() 7N2+12H2O SiO2+2OH-=SiO32-+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
7N2+12H2O SiO2+2OH-=SiO32-+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】(1)①实验室利用熟石灰和氯化铵加热制备制取氨气,反应的化学方程式是2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;②由于氨气易溶于水,使装置中的压强小于外界的压强,从而会引起倒吸;(2)氨气催化氧化的方程式为4NH3+5O2
CaCl2+2NH3↑+2H2O;②由于氨气易溶于水,使装置中的压强小于外界的压强,从而会引起倒吸;(2)氨气催化氧化的方程式为4NH3+5O2![]() 4NO+6H2O;(3)① NO2溶于水生成硝酸和NO,反应的化学方程式是3NO2+H2O=2HNO3+NO;②根据方程式4NO2+O2+2H2O=4HNO3可知使试管中NO2恰好完全被水吸收需要通入标准状况下氧气的体积为V/4mL。根据方程式可知最终试管中所的硝酸的物质的量浓度为
4NO+6H2O;(3)① NO2溶于水生成硝酸和NO,反应的化学方程式是3NO2+H2O=2HNO3+NO;②根据方程式4NO2+O2+2H2O=4HNO3可知使试管中NO2恰好完全被水吸收需要通入标准状况下氧气的体积为V/4mL。根据方程式可知最终试管中所的硝酸的物质的量浓度为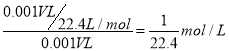 ;③为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该物质是氮气,反应的化学方程式是6NO2+8NH3=7N2+12H2O;(4)二氧化硅能溶于氢氧化钠溶于,因此除掉Fe2O3中的SiO2的试剂是氢氧化钠溶于,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
;③为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该物质是氮气,反应的化学方程式是6NO2+8NH3=7N2+12H2O;(4)二氧化硅能溶于氢氧化钠溶于,因此除掉Fe2O3中的SiO2的试剂是氢氧化钠溶于,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

 名校课堂系列答案
名校课堂系列答案