题目内容
【题目】锌焙砂是锌精矿经焙烧后所得的产物,主要含ZnO、ZnSO4,有少量FeO、CuO、NiO杂质,是炼锌最主要的原料。某科研小组设计了如下提取金属锌的实验流程:
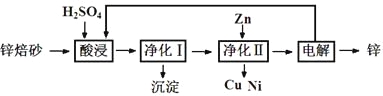
(1)酸浸时需要240 mL 4 mol·L-1稀H2SO4,用18.4 mol·L-1浓硫酸配制该稀H2SO4过程
中用到的玻璃仪器除烧杯、量筒、胶头滴管外,还要 、 ;酸浸得到的溶液中除Zn2+、Ni2+外,还含有的金属阳离子是 、 (填离子符号)。
(2)净化Ⅰ需要加入H2O2,加入H2O2时发生的离子反应方程式是 ;反应后控制溶液pH为4即沉淀完全,沉淀的主要成分是 。
(3)净化Ⅱ得到的Cu、Ni,需要进行洗涤操作,检验是否洗涤干净的方法是 ;本流程中可以循环利用的物质除锌外还有 、 。
(4)可用电解沉积硫酸锌溶液的方法制备锌,若在在阳极产生13.44L(标准状况下) 氧气,在阴极析出锌的质量为 。
(5)上述工艺中,如果不设计 “净化Ⅱ”,对提取金属锌造成的影响是____________________。
【答案】(1)250 mL容量瓶、玻璃棒;Cu2+、Fe2+
(2)H2O2+2Fe2++2H+=2Fe3++2H2O(2分);Fe(OH)3(1分)
(3)取最后洗涤液少量,滴加BaCl2,若无白色沉淀,则洗干净(2分);
H2SO4、ZnSO4(各1分,共2分)
(4)78g(2分)(5)最终得到的产品中含Cu、Ni杂质(2分)
【解析】试题分析:(1)锌焙砂经被烧后所得的产物,主要含氧化锌、硫酸锌(有少量FeO、CuO、NiO杂质),加入硫酸酸化,可生成硫酸锌、硫酸铜、硫酸镍以及硫酸亚铁等,因此酸浸得到的溶液中除Zn2+外,还含有的金属阳离子有Cu2+、Fe2+、Ni2+等,用浓硫酸配制稀硫酸需要的仪器有:量筒量取浓硫酸、烧杯用来溶解浓硫酸、玻璃棒搅拌、引流等、胶头滴管定容以及250mL容量瓶等;
(2)净化Ⅰ操作需要加入H2O2溶液并控制溶液的pH在4左右,亚铁离子被双氧水氧化成铁离子,反应的离子方程式为H2O2 + 2Fe2+ + 2H+=2Fe3+ + 2H2O,控制溶液pH,使Fe3+转化为Fe(OH)3沉淀;
(3)净化Ⅱ得到的Cu、Ni可吸附溶液中的硫酸根离子,检验是否洗涤干净,可取最后一次洗涤液于小试管中,滴加硝酸酸化的BaCl2溶液,如无沉淀生成,说明洗涤干净,通过制取金属锌的流程图示可以知道,可以循环利用的物质除锌外,含有硫酸、硫酸锌;
(4)13.44L(标准状况下) 氧气n=V/Vm=13.44/22.4L/mol=0.6mol,转移电子0.6mol×4=2.4mol,生成1mol锌需转移2mol电子,所以在阴极析出锌的质量为:2.4mol/2×65g/mol=78g;
(5)上述工艺中,如果不设计“净化Ⅱ”,溶液中含有Cu2+、Ni2+,电解会造成的结果是最终得到的产品中含Cu、Ni杂质。