题目内容
【题目】t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1) 从开始反应至达到平衡的状态,生成C平均反应速率为 .
(2) x= ;平衡常数K= .
(3) 若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母) ;
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
【答案】(1)0.2mol/Lmin(2)4 ![]() (3)C
(3)C
【解析】
试题分析:(1)从开始至达到平衡的状态,生成C平均反应速度=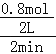 =0.2mol/Lmin,故答案为:0.2mol/Lmin;
=0.2mol/Lmin,故答案为:0.2mol/Lmin;
(2)依据化学平衡三段式列式计算,平衡状态并测定C的浓度为0.4mol/L,物质的量为0.8mol
3A(g)+B(g)![]() xC(g)
xC(g)
起始量(mol) 3 1 0
变化量(mol) 0.6 0.2 0.2x
平衡量(mol) 2.4 0.8 0.8
0.2x=0.8解得x=4
上述计算可知x=4,平衡常数K=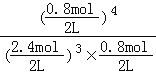 =
=![]() ,
,
(3)若继续向原混合物的容器中通入少量氦气,恒温恒容容器,加入惰气总压增大,分压不变,平衡不动,故答案为:C.

练习册系列答案
相关题目