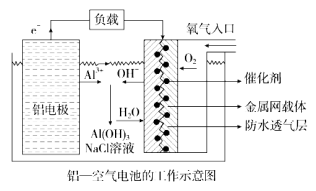
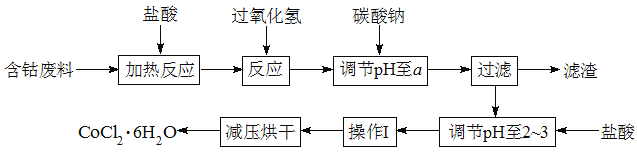
题目内容
【题目】 0.2 molX元素的离子被还原成中性原子时,需要得到2.408×1023个电子,0.3gX的单质与足量盐酸反应放出0.015g氢气;X的中子数和质子数相等;Y的原子半径是其所在周期元素中最小的,它的阴离子结构与氩原子结构相同。
(1)计算X的相对原子质量(写出计算过程)
(2)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。
【答案】(1)40 (2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】(1)0.2molX元素的离子被还原成中性原子时,需要得到2.408×1023个电子,X离子得电子被还原,电子的物质的量是0.4mol,二者的物质的量之比等于微粒个数之比,则每个X离子得到2个电子生成原子或单质;0.3gX的单质与足量盐酸充分反应放出0.015g氢气,则X是金属元素,其阳离子为二价阳离子,X与盐酸反应生成金属阳离子时,根据转移电子守恒得n(H2)=n(X),M(X)=![]() =40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素,故答案为:40;
=40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素,故答案为:40;
(2)Y元素的阴离子结构与氩原子结构相同,Y的原子半径是其所在周期元素中最小的,,则Y为Cl元素。X最高价氧化物对应的水化物为氢氧化钙,氯气与氢氧化钙反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。

练习册系列答案
相关题目